LK 1.1 Modul 1 Bidang Studi-Profesional Putu Eka Surya Putra
Diunggah oleh
bendaharawan smansatapklumpu0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
37 tayangan8 halamanHak Cipta
© © All Rights Reserved
Format Tersedia
DOC, PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOC, PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
37 tayangan8 halamanLK 1.1 Modul 1 Bidang Studi-Profesional Putu Eka Surya Putra
Diunggah oleh
bendaharawan smansatapklumpuHak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOC, PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 8
Nama : Putu Eka Surya Putra
No. Peserta :
LK 1.1 Lembar Kerja Belajar Mandiri
Judul Modul 1. Struktur Atom dan Sistem Periodik Unsur
Judul Kegiatan Belajar (KB) 1.Perkembangan teori atom
2.Atom, molekul dan ion
3.Sistem Periodik Unsur (SPU)
4.Sifat keperiodikan unsur
No Butir Refleksi Respon/Jawaban
1 Daftar peta konsep (istilah dan KB. 1. Perkembangan teori atom
definisi) di modul ini 1. Pada hakikatnya semua zat kimia tersusun atas
atom (1).
2. Democritus mengungkapkan keyakinan bahwa
semua materi terdiri atas partikel yang sangat
kecil dan tidak dapat dibagi lagi (4)
3. Atomisme adalah filsafat alam yang
berkembang di peradaban kuno (hal. 4).
4. Senyawa tersusun atas atom-atom dari dua
unsur atau lebih (hal. 4).
5. Konservasi massa adalah persamaan dari
kekekalan massa. “Materi tidak dapat
diciptakan maupun dimusnahkan. Karena
materi kimia tersusun atas atom-atom yang
tidak berubah dalam suatu reaksi dasar kimia,
maka massa juga harus kekal" (hal. 5)
6. Partikel dasar adalah yang lebih kecil dari
atom yaitu elektron, proton dan neutron (hal.
7)
7. Law of multiple proportion menyatakan
Jika dua unsur dapat bergabung membentuk
lebih dari satu senyawa, maka massa-massa
dari unsur yang pertama dengan suatu massa
tetap dari unsur yang kedua akan berbanding
sebagai bilangan bulat yang sederhana.
8. Isotop adalah atom unsur yang sama tetapi
berbeda massa (hal. 8)
9. Tabung katoda adalah tabung kaca yang
sebagian besar udaranya sudah disedot keluar
(hal. 8)
10. Pendaran adalah pencaran cahaya (hal. 8)
11. Tabung crookes adalah seperti tabung katoda
tetapi katoda dibuat berlubang dan diletakkan
agak kedalam (hal. 9)
12. Nucleus adalah inti (hal. 13)
13. Stasioner adalah tingkat energi tertentu (hal.
14)
14. Frekuensi adalah jumlah getaran yang
dihasilkan setiap satu detik (hal. 14)
15. Gelombang Elektromagnetik yaitu
gelombang listrik dan magnet yang bergerak
bersamaan menuju satu arah, tetapi dalam
bidang gelombang yang saling tegak lurus
( hal.14 )
16. Amplitudo gelombang elektromagnetik adalah
ukuran kekuatan medan listrik dan magnet nya
(hal. 15)
17. Spektrum adalah rentetan warna kontiniu yang
diperoleh apabila cahaya diuraikan ke dalam
komponennya (hal. 16)
18. Kuanta adalah atom-atom dalm suatu zat
hanya dapat menyerap atau memancarkan
energi pada paket-paket gelombang tertentu
(hal. 19)
19. Efek Zeeman adalah jika atom ditempatkan
pada medan magnet , dijumpai spektrum emisi
yang lebih rumit (hal. 21)
20. Orbital adalah daerah kebolehjadian terbesar
ditemukannya elektron dalam atom (hal. 23)
21. Azimuth adalah menyatakan bentuk orbital
(hal. 24)
22. Spin adalah perputaran arah rotasi elektron
(hal. 25)
KB. 2. Atom, molekul dan ion
1. Partikel materi adalah bagian terkecil dari
suatu materi (hal 4).
2. Elektron adalah partikel penyusun atom
yang bermuatan negatif (hal. 5)
3. Proton adalah partikel positif yang terpusat
pada inti atom(hal. 5)
4. Teori atom Thompson terdiri dari partikel
bermuatan positif yang di permukaannya
bertaburan elektron (hal. 5)
5. Neutron adalah partikel yang tidak
bermuatan dan memiliki masa yang sama
dengan proton (hal. 6)
6. Perbedaan atom suatu unsur dengan unsur
yang lain adalah jumlah proton dan
neutron dalam inti dan jumlah elektron
yang mengelilinginya (hal 6)
7. Nomor Atom adalah jumlah proton dalam
inti setiap atom suatu unsur (hal. 6)
8. Nomor massa (mass number) adalah
jumlah total netron dan proton yang ada
dalam inti atom suatu unsur (hal. 7)
9. Massa atom merupakan massa dari seluruh
partikel penyusun atom (hal. 7)
10.Molekul adalah suatu agregat (kumpulan)
yang terdiri dari sedikitnya dua atom
dalam susunan tertentu yang terkait
bersama oleh gaya-gaya kimia (hal. 7)
11.Gaya-gaya kimia adalah disebut juga
ikatan kimia (hal. 7)
12.Molekul dapat mengandung atom-atom
dari unsur yang sama atau atom-atom dari
atau lebih unsur yang bergabung dengan
perbandingan tertentu, sesuai dengan
hukum perbandingan tetap (hal.7)
13.Ikatan kimia adalah gaya tarik menarik
antara dua atom atau molekul yang
menyebabkan suatu senyawa menjadi
stabil (hal. 7)
14.Molekul diatomik adalah molekul yang
hanya mengandung dua atom(hal. 8)
15.Molekul Poliatomik adalah molekul yang
mengandung lebih dari dua molekul
(hal.8)
16.Rumus molekul menunjukkan jumlah
eksak atom-atom dari setiap unsur di
dalam unit terkecil suatu zat (hal.8)
17.Rumus empiris adalah perbandingan
bilangan bulat paling sederhana dari atom-
atomnya, tetapi tidak semua molekul (hal.
9)
18.Rumus empiris adalah rumus kimia yang
paling sederhana; rumus ini ditulis dengan
memperkecil subkrip dalam rumus
molekul menjadi bilangan bulat terkecil
yang mungkin (hal.9)
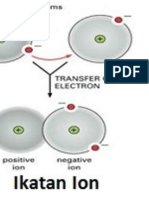
19.Senyawa ionik adalah senyawa kimia yang
tersusun dari ion-ion yang disatukan oleh
gaya elektrostatik (hal 10)
20.Anion adalah ion negatif.
21.Kation adalah ion positif.
22.Ion adalah sebuah atom atau sekelompok
atom yang mempunyai muatan total positif
atau negatif (hal. 12)
23.Ion monatomik (monoatomic ion) adalah
ion yang hanya mengandung satu atom
(hal. 13)
24.Ion poliatomik (polyatomic ion) adalah
ion yang hanya mengandung lebih dari
satu atom (hal. 13)
25.Isotop adalah atom yang memiliki nomor
atom yang sama tetapi berbeda nomor
massanya (hal. 14)
26.Isobar adalah atom-atom yang memiliki
nomor atom berbeda tetapi memiliki
nomor massa yang sama (hal. 15)
27.Isoton adalah atom-atom yang memiliki
nomor atom dan nomor massa berbeda
tetapi memiliki jumlah neutron yang sama
(hal. 16)
28.Isoelektron adalah unsur atau ion yang
mempunyai jumlah elektron sama (hal. 16)
29.Senyawa molekuler adalah bersangkutan
dengan molekul (hal. 19)
30. Senyawa biner adalah senyawa yang
terbentuk dari hanya dua unsur (hal 18)
31. Senyawa tersier (ternary coumpound)
adalah senyawa yang tersusun atas tiga
unsur (hal 18).
32. Asam (acid) dapat digambarkan sebagai
zat yang menghasilkan ion hidrogen (H+ )
ketika dilarutkan dalam air.
33.Asam okso (oxoacid) adalah asam yang
mengandung hidrogen, oksigen dan unsur
lain (unsur pusat).
34.Basa (base) dapat digambarkan sebagai zat
yang menghasilkan ion hidroksida (OH- )
KB. 3. Sistem Periodik Unsur
1. Sistem periodik unsur berkembang dari
sistem periodik Lavoisier dimana Lavoisier
mengelompokkan unsur kimia berdasarkan
kemiripan sifat.
2. Triade Dobereiner adalah kelompok tiga
unsur yang memiliki kemiripan sifat yang
ada hubungannya dengan massa atom
relatif (hal. 6)
3. Suatu triade adalah tiga unsur yang disusun
berdasarkan kenaikan massa atom relatif
(Ar)-nya, sehingga Ar unsur kedua kira-
kira sama dengan rata-rata Ar unsur
pertama dan ketiga.
4. Hukum Oktaf Newland adalah penyusunan
kelompok unsur yang memiliki hubungan
antara sifat unsur dan massa atom relatif
nya (hal. 7)
5. “Jika unsur disusun berdasarkan kenaikan
massa atom relatifnya, maka pada unsur
kedelapan sifatnya mirip dengan unsur
yang pertama, dan unsur yang kesembilan
dengan unsur yang kedua, dan seterusnya”
6. Sistem periodik Meyer lebih menekankan
perhatiannya pada sifat-sifat fisika. Unsur-
unsur yang sifatnya mirip, terletak di
tempat tertentu dalam setiap bagian tabel
yang mirip bentuknya.
7. Eka aluminium adalah unsur pertama
dibawah aluminium dalam golongan yang
sama (hal. 10)
8. Mendeleev menggunakan sifat-sifat fisika
dan sifat kimia untuk menyusun daftar
unsur-unsur berdasarkan kenaikan massa
atom relatif. Susunan unsur Mendeleev ini
merupakan sistem periodik pertama atau
sering disebut dengan sistem periodik
unsur bentuk pendek
9. Hukum periodik adalah hukum yang
berbunyi sifat unsur-unsur merupakan
fungsi periodik/ berkala dari massa atom
relatif nya ( hal. 12)
10. Valensi adalah jumlah elektron suatu atom
yang dilepas atau diterima atau digunakan
bersama dengan atom lain untuk
mendapatkan konfigurasi yang stabil.
11. Anomali adalah penyimpangan (hal. 14)
12. Holes adalah lubang atau celah (hal. 15)
13. Metaloid adalah kelompok unsur kimia
yang memiliki sifat antara logam dan non
logam (hal. 17)
14. Lantanida adalah kelompok unsur kimia di
transisi bagian dalam dan mengikuti
lantanum (hal. 19)
15. Aktinida adalah kelompok unsur kimia di
transisi bagian dalam dan mengikuti
actinium (hal. 19)
16. Elektronadalah partikel penyusun atom
yang bermuatan negatif (hal. 20)
KB. 4. Sifat Keperiodikan unsur
1. Sifat keperiodikan unsur menjelaskan sifat
unsur yang berubah secara beraturan.
2. Jari-jari atom adalah setengah jarak inti
dua atom yang sama dalam ikatan tunggal
(hal. 5)
3. Kerapatan elektron adalah ukuran
probabilitas elektron yang hadir di lokasi
tertentu (hal. 5)
4. Muatan inti efektif adalah muatan positif
bersih yang dialami oleh sebuah elektron
dalam atom polielektronik (hal. 6)
5. Energi ionisasi adalah energi minimum
yang diperlukan untuk melepaskan satu
elektron dari atom berwujud gas pada
keadaan dasarnya (hal. 13)
6. Afinitas elektron adalah besarnya energi
yang dilepaskan atau diserap oleh suatu
atom dalam wujud gas untuk membentuk
anion (hal. 20)
7. Keelektronegatifan adalah suatu bilangan
yang menggambarkan kecendrungan relatif
suatu unsur menarik elektron ke pihaknya
dalam suatu ikatan kimia (hal. 22)
2 Daftar materi yang sulit KB. 1. Perkembangan teori atom
dipahami di modul ini 1. Momentum sudut kecepatan elektron
dalam Teori Bohr.
2. Radiasi energi saat terjadi perpindahan
elektron dalam Teori Atom Bohr.
3. Hubungan sudut dan panjang gelombang
saat seberkas cahaya matahari yang
melewati prisma akan terurai menjadi
tujuh warna: merah, jingga, kuning, hijau,
biru, nila lembayung (hal. 17)
4. Pernyataan Maxwell (1873) yang
menyatakan bahwa cahaya adalah
gelombang elektromagnetik, yaitu
gelombang listrik dan magnet yang
bergerak bersamaan menuju satu arah,
tetapi dalam bidang gelombang yang
saling tegak lurus (hal. 14).
5. Penjelasan spektum hidrogen yang
dihubungkan dengan Deret Lyman,
Balmer, Paschen, dan deret lainnya
6. Max Planck, terdapat hubungan antara
panjang gelombang dengan energi dari
suatu gelombang elektromagnetik, tetapi
penjelasannya tidak berdasarkan teori
fisika klasik
KB. 2. Atom, molekul dan ion
1. Perbedaan jelas antara makna unsur,
molekul, senyawa, molekul unsur dan
molekul senyawa.
2. Senyawa biner dan senyawa tersier.
Apakah senyawa kompleks merupakan
senyawa tersier ataukah tersendiri?
KB. 3. Sistem Periodik Unsur
1. Studi Moseley juga memungkinkan untuk
mengidentifikasi "holes" dalam tabel
periodik, yang mengarah pada penemuan
unsur yang sebelumnya tidak diketahui
(hal. 15)
2. Makna bunyi hukum periodik “Sifat unsur-
unsur merupakan fungsi periodik/ berkala
dari massa atom relatifnya”.
3. Golongan VIIIA, disebut gas mulia, dulu
disebut gas inert sampai diketahui bahwa
anggota yang lebih berat dari golongan
tersebut menunjukkan tingkat reaktivitas
kimia yang kecil (hal. 19)
KB. 4. Sifat Keperiodikan unsur
1. Kesulitan menguasai konsep Shielding
Effect atau efek perisai.
2. Sulit menguasai konsep energi ionisasi
pertama dan kedua
3. Sulit memahami afinitas elektron,
keelektronegatian, muatan inti efektif,
4. Sulit memahami jari-jari atom dan ion.
5. Pengecilan jari-jari terjadi karena elektron
saling tolak menolak, dan bila satu
elektron keluar maka daya tolaknya
menjadi lebih kecil, sehingga terjadi
pengerutan seperti Al menjadi Al+.(hal. 17)
3 Daftar materi yang sering KB. 1. Perkembangan teori atom
mengalami miskonsepsi 1. Atom terdiri dari inti yang bermuatan
positif yang merupakan terpusatnya massa.
Di sekitar inti terdapat elektron yang
bergerak mengelilinginya dalam ruang
hampa. Sering terjadi kebingungan
pemaknaan ruang hampa tersebut.
2. Pada saat elektron berpindah pada satu
orbit ke orbit yang lain memancarkan
spektrum (energi yang ditangkap layar),
dimana warna menggambarkan
penyerapan energi.
KB. 2. Atom, molekul dan ion
1. Rumus empiris adalah rumus kimia yang
paling sederhana; rumus ini ditulis
dengan memperkecil subkrip dalam rumus
molekul menjadi bilangan bulat terkecil
yang mungkin.
2. Pemahaman antara rumus kimia, rumus
empiris dan rumus senyawa serta rumus
molekul.
KB. 3. Sistem Periodik Unsur
1. Posisi Aktinida dan Lantanida dalam
Sistem Periodik Unsur.
2. Banyak Unsur yang terletak di sepanjang
garis yang memisahkan logam dari bukan
logam memiliki sifat yang jatuh di antara
logam dan logam. Unsur-unsur ini sering
disebut sebagai metaloid. Sifat-sifat
metaloid dan semilogam.
KB. 4. Sifat Keperiodikan unsur
1. Perhitungan jari-jari atom dan diameter
atom.
2. Pemaknaan Afinitas dan Enegri Ionisasi.
Anda mungkin juga menyukai
- LK 1 - Lembar Kerja Belajar Mandiri - Modul 1Dokumen4 halamanLK 1 - Lembar Kerja Belajar Mandiri - Modul 1putraBelum ada peringkat
- LKPD Ikatan KimiaDokumen17 halamanLKPD Ikatan KimiaKahar UnhaluBelum ada peringkat
- LK 1 - Lembar Kerja Belajar Mandiri - Modul 2-DikonversiDokumen3 halamanLK 1 - Lembar Kerja Belajar Mandiri - Modul 2-DikonversiputraBelum ada peringkat
- LK 1 - Pedagogi 1 KB 1 Dan 2Dokumen2 halamanLK 1 - Pedagogi 1 KB 1 Dan 2silvi nafidahBelum ada peringkat
- Analisis Penerapan Materi - Modul 4Dokumen5 halamanAnalisis Penerapan Materi - Modul 4silvi nafidahBelum ada peringkat
- LK 2 Modul 2 Indah SartikaDokumen3 halamanLK 2 Modul 2 Indah SartikaIndah SartikaBelum ada peringkat
- RPP Ikatan KimiaDokumen2 halamanRPP Ikatan KimiaMine TambsBelum ada peringkat
- Analisis Penerapan Materi - Modul 1Dokumen2 halamanAnalisis Penerapan Materi - Modul 1silvi nafidahBelum ada peringkat
- RPP Tata Nama SenyawaDokumen9 halamanRPP Tata Nama SenyawaX-bal Nack Rezhta0% (1)
- RPP Ikatan IonDokumen11 halamanRPP Ikatan IonMark KakaBelum ada peringkat
- Fifin Lembar Refleksi Materi AjarDokumen3 halamanFifin Lembar Refleksi Materi AjarFifin WijayantiBelum ada peringkat
- LK 2.1 AwalDokumen1 halamanLK 2.1 AwalMirza Irwansyah AmmaryBelum ada peringkat
- RPP Benzena Dan TurunannyaDokumen8 halamanRPP Benzena Dan TurunannyasulistyowatiBelum ada peringkat
- Modul Ajar Kimia Tabel PeriodikDokumen12 halamanModul Ajar Kimia Tabel PeriodikHastuti HastutiBelum ada peringkat
- TRIYASMINA Modul Ikatan KimiaDokumen46 halamanTRIYASMINA Modul Ikatan KimiaAmie JasmineBelum ada peringkat
- LK 2 - Lembar Kerja Refleksi Modul 2 Bidang Studi Jurnal Harian Edi SusiloDokumen3 halamanLK 2 - Lembar Kerja Refleksi Modul 2 Bidang Studi Jurnal Harian Edi Susiloedi susiloBelum ada peringkat
- Laporan PTK Kimia Metode JigsawDokumen41 halamanLaporan PTK Kimia Metode Jigsawg2da99% (82)
- PPG MateriDokumen6 halamanPPG MateriMaria Fitria NingsihBelum ada peringkat
- RPP Kimia Kls X SMK AgribisnisDokumen7 halamanRPP Kimia Kls X SMK AgribisnisNi Luh Cicik FirtianiBelum ada peringkat
- RPP Hidrokarbon ISOMERDokumen8 halamanRPP Hidrokarbon ISOMERraniBelum ada peringkat
- RPP LK - Kimia - Willi & TytoDokumen32 halamanRPP LK - Kimia - Willi & TytoDekabris Avogardo GeraldBelum ada peringkat
- Forum Diskusi m1kb1Dokumen13 halamanForum Diskusi m1kb1Lisbet Mariana SimbolonBelum ada peringkat
- Tugas 1.4. Bahan Evaluasi PPG KimiaDokumen7 halamanTugas 1.4. Bahan Evaluasi PPG KimiaSMA ABBSBelum ada peringkat
- RPP KD 3.2Dokumen15 halamanRPP KD 3.2Dian HerawatiBelum ada peringkat
- 2 MODUL BAHAN AJAR KIMIA F 1 - Perhitungan Dan Konsep Mol - RevisiDokumen16 halaman2 MODUL BAHAN AJAR KIMIA F 1 - Perhitungan Dan Konsep Mol - RevisiMad Rohim KhasBelum ada peringkat
- RPP Kimia Karbon Kelas 12 BaruDokumen23 halamanRPP Kimia Karbon Kelas 12 BaruNisa aprlnaBelum ada peringkat
- RPP Kimia Kelas X Semester 1Dokumen28 halamanRPP Kimia Kelas X Semester 1Lyana BeeBelum ada peringkat
- 6 RPP PBL 2Dokumen8 halaman6 RPP PBL 2Rani Khoiriyah Az-zahraBelum ada peringkat
- Contoh RPP Model K-13 LanskapDokumen5 halamanContoh RPP Model K-13 LanskapwakasekBelum ada peringkat
- RPP Bentuk Molekul Dan Gaya Antar MolekulDokumen5 halamanRPP Bentuk Molekul Dan Gaya Antar MolekulIrmaWati100% (1)
- BAB 2. Hubungan Konfigurasi ElektronDokumen29 halamanBAB 2. Hubungan Konfigurasi ElektronRuun Sanah JuniorBelum ada peringkat
- Modul Ajar Ikatan KimiaDokumen3 halamanModul Ajar Ikatan KimiasusiBelum ada peringkat
- LKPD Persamaan ReaksiDokumen11 halamanLKPD Persamaan ReaksiDeden Putra sundaBelum ada peringkat
- RPP 3.8 Konsep Mol Dalam StikiometriDokumen13 halamanRPP 3.8 Konsep Mol Dalam StikiometriUtha ThuxBelum ada peringkat
- RPP Ikatan Kimia Kovalen IonDokumen23 halamanRPP Ikatan Kimia Kovalen IonMuhammad FadhliBelum ada peringkat
- LK 1 - Lembar Kerja Belajar Mandiri - Modul 2Dokumen2 halamanLK 1 - Lembar Kerja Belajar Mandiri - Modul 2putraBelum ada peringkat
- RPP Hukum Dasar KimiaDokumen12 halamanRPP Hukum Dasar KimiaLidya anggri noveliaBelum ada peringkat
- Modul Ajar Konfigurasi ElektronDokumen17 halamanModul Ajar Konfigurasi ElektronNur FitriaBelum ada peringkat
- Lembar Kerja Peserta Didik - TermokimiaDokumen2 halamanLembar Kerja Peserta Didik - TermokimiaDewi MarhellyBelum ada peringkat
- LKPD Larutan Elektroli Non ElektrolitDokumen32 halamanLKPD Larutan Elektroli Non ElektrolitYusuf SupriantoBelum ada peringkat
- Refleksi Modul 5Dokumen2 halamanRefleksi Modul 5EKO BUDI PBelum ada peringkat
- RPP Bentuk MolekulDokumen21 halamanRPP Bentuk Molekulintan dwi lestariBelum ada peringkat
- RPP Alkena Alkuna, Isomer, Sifat FisikDokumen10 halamanRPP Alkena Alkuna, Isomer, Sifat FisikMuhamad Ainun RosyidBelum ada peringkat
- 3 3 RPP Struktur Atom SMK TEKNOLOGI DAN REKAYASA KURIKULUM 2013 KELAS XDokumen13 halaman3 3 RPP Struktur Atom SMK TEKNOLOGI DAN REKAYASA KURIKULUM 2013 KELAS XMariani SilalahiBelum ada peringkat
- RPP Kimia KD 3 1 3 5 - Xi - Man - 17 18Dokumen37 halamanRPP Kimia KD 3 1 3 5 - Xi - Man - 17 18Yuni Sri MulyaniBelum ada peringkat
- RPP Metode IlmiahDokumen6 halamanRPP Metode IlmiahintanBelum ada peringkat
- RPP Berdiferensiasi Mapel Kimia Dan Instrumen PenilaiannyaDokumen27 halamanRPP Berdiferensiasi Mapel Kimia Dan Instrumen PenilaiannyaPutu Sri AryudihatiBelum ada peringkat
- Contoh PTK KimiaDokumen23 halamanContoh PTK KimiaAnonymous eDZwyFWYlBelum ada peringkat
- RPP Persamaan ReaksiDokumen21 halamanRPP Persamaan Reaksiwima pudyaBelum ada peringkat
- RPP 10 KoloidDokumen16 halamanRPP 10 KoloidDeden Aldila ZulkhidaBelum ada peringkat
- HEPTANA - FITRIA N - RPP KELAS X (Asam Basa) RevDokumen2 halamanHEPTANA - FITRIA N - RPP KELAS X (Asam Basa) RevFitria NurwindayaniBelum ada peringkat
- Refleksi Pembelajaran Modul 1Dokumen3 halamanRefleksi Pembelajaran Modul 1bendaharawan smansatapklumpuBelum ada peringkat
- Modul Ajar Struktur Atom 5.2Dokumen6 halamanModul Ajar Struktur Atom 5.2Ihda FitriyatiBelum ada peringkat
- RPP Tatanama SenyawaDokumen19 halamanRPP Tatanama SenyawaErla RatnawatiBelum ada peringkat
- RPP Laju GDL-PK (Pert1-2) FitriDokumen14 halamanRPP Laju GDL-PK (Pert1-2) FitriFitri Ameita SaryBelum ada peringkat
- LKPDDokumen8 halamanLKPDShareeva Danish WijayaBelum ada peringkat
- LK 1.1 Lembar Kerja Mandiri Modul 1 Profesional-FifinDokumen8 halamanLK 1.1 Lembar Kerja Mandiri Modul 1 Profesional-FifinFifin Wijayanti100% (3)
- LK 1 - Modul 1 ProfesionalDokumen6 halamanLK 1 - Modul 1 Profesionalzaitun fazilahBelum ada peringkat
- LK 0.1 Lembar Kerja Belajar MandiriDokumen38 halamanLK 0.1 Lembar Kerja Belajar MandiriWa Ode Inang Alistawati100% (1)
- LK 0.1 Modul 1 Struktur Atom Dan Spu - Tri Amallia SeftianaDokumen6 halamanLK 0.1 Modul 1 Struktur Atom Dan Spu - Tri Amallia SeftianaTri Amallia SeftianaBelum ada peringkat
- LKPD BlendedDokumen12 halamanLKPD Blendedbendaharawan smansatapklumpuBelum ada peringkat
- Materi New Model Peerteaching PPG Daljab 2021Dokumen3 halamanMateri New Model Peerteaching PPG Daljab 2021bendaharawan smansatapklumpuBelum ada peringkat
- RPP BlendedDokumen8 halamanRPP Blendedbendaharawan smansatapklumpuBelum ada peringkat
- Rubrik Penilaian LuringDokumen23 halamanRubrik Penilaian Luringbendaharawan smansatapklumpuBelum ada peringkat
- Bahan Ajar Daring - Putu Eka Surya PutraDokumen8 halamanBahan Ajar Daring - Putu Eka Surya Putrabendaharawan smansatapklumpuBelum ada peringkat
- Draf RPP DaringDokumen12 halamanDraf RPP Daringbendaharawan smansatapklumpuBelum ada peringkat
- RPP LuringDokumen7 halamanRPP Luringbendaharawan smansatapklumpuBelum ada peringkat
- Refleksi Pembelajaran Modul 1Dokumen3 halamanRefleksi Pembelajaran Modul 1bendaharawan smansatapklumpuBelum ada peringkat
- LK 2.1 Identifikasi Masalah Hari Ketiga - Putu Eka Surya PutraDokumen26 halamanLK 2.1 Identifikasi Masalah Hari Ketiga - Putu Eka Surya Putrabendaharawan smansatapklumpuBelum ada peringkat
- Jadwal Hadir Panitia PPDBDokumen8 halamanJadwal Hadir Panitia PPDBbendaharawan smansatapklumpuBelum ada peringkat
- Jawaban Diskusi KB 1Dokumen2 halamanJawaban Diskusi KB 1bendaharawan smansatapklumpuBelum ada peringkat
- Hasil Diskusi KB 2Dokumen3 halamanHasil Diskusi KB 2bendaharawan smansatapklumpuBelum ada peringkat
- Tes Sumatif Modul E KIMIADokumen8 halamanTes Sumatif Modul E KIMIAbendaharawan smansatapklumpuBelum ada peringkat
- 5 6224508167208829280Dokumen5 halaman5 6224508167208829280bendaharawan smansatapklumpuBelum ada peringkat