LK 1 - Modul 4
Diunggah oleh
Esty Badar Fauzulia0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
96 tayangan6 halamanJudul Asli
LK 1- MODUL 4
Hak Cipta
© © All Rights Reserved
Format Tersedia
DOCX, PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
96 tayangan6 halamanLK 1 - Modul 4
Diunggah oleh
Esty Badar FauzuliaHak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 6
LK 1: Lembar Kerja Belajar Mandiri
Judul Modul Dasar Dasar Kimia Analisis
Judul Kegiatan Belajar (KB) 1. Analisisi Kualitatif dan Kuantitatif Klasik
(Gravimetri, Volumetri)
2. Elektrometri
3. Spektrofotometri
4. Kromatografi
No Butir Respon/Jawaban
Refleksi
1 Daftar KB1. Analisisi Kualitatif dan Kuantitatif Klasik (Gravimetri, Volumetri)
peta 1. Analisis Kualitatif /analisis jenis adalah analisa yang digunakan untuk
konsep menentukan macam atau jenis zat atau komponen bahan menggunakan
sifat fisika atau kimia dari zat atau bahan yang akan dianalisis.
(istilah
Berdasarkan metode:
dan a. Analisis Kualitatif berdasar sifat fisis :
definisi) di i. Analisis pendahuluan adalah analisa yang berdasar pada :
modul ini - Warna bau, bentuk/wujud sampel
- Kelarutan
- Keasaman larutan
- Pemanasan zat pada pipa pijar(perubahan warna, meumer,
menyublim, keluar uap airgas, tes nyala)
ii. Analisis Sifat fisis, ditentukan oleh :
- Titik leleh adalah suhu dimana terjadi keadaan setimbang
antara fasa padat dan fasa cair
- Pengamatan bentuk kristal
- Indeks bias menunjukkan suatu ukuran seberapa besar suatu
bahan membiaskan cahaya atau bisa dikatakan indeks bias
suatu zat adalah perbandingan kelajuan cahaya di udara
dengan kelajuan cahaya di dalam zat tersebut. Alat yang
digunakan untuk melihat indeks bias cahaya adalah
refraktometer
- Titik didih adalah suhu dimana tekanan uap jenuh zat cair
sama dengan tekanan udara luar
- Sifat keasaman dan kebasaan sampel
b. Analisis Kualitatif Kation dan Anion
i. Analisis Kation berdasarkan Sistem H2S, metode analisa yang
didasarkan pada pengendapan sulfida dalam pH tertentu.
Pemisahan dilakukan dengan cara mengendapkan kelompok kation
tertentu dari larutannya. Jenis Kation:
- Golongan I : Pb2+, Hg+, Ag+
- Golongan II : Hg2+, Pb2+, Bi3+, Cu2+, Cd2+, As3+, As5+, Sb3+, Sb5+,
Sn2+, Sn4+
- Golongan III : Co2+, Ni2+, Fe2+, Zn2++, Mn2+, Cr3+, Mn2+, Cr3+, Al3+
- Golongan IV : Ca2+, Sr2+, Ba2+
- Golongan V : Mg2+, Na+, K+, NH4+
ii. Analisis Anion adalah pemisahan anion berdasarkan kelarutan
garam – garam perak, garam kalsium, barium dan seng.
2. Analisis Kuantitatif Klasik adalah analisa yang dilakukan untuk
menentukan jumlah zat yang terkandung di dalam suatu sampel :
a. Analisis Gravimetri merupakan teknik analisis yang didasarkan atas
pengukuran massa. Metode :
i. Secara konvesional :
- Metode pengendapan , analit dipisahkan dari larutan sampel
sebagai endapan dan diubah menjadi senyawa yang diketahui
komposisinya dan dapat ditimbang
- Metode penguapan, analit dipisahkan dari konstituen lain dalam
sampel dengan diubah menjadi gas yang diketahui
komposisinya.
- Gravimetri partikulat, analit dipisahkan dari matrik dengan
penyaringan atau ekstraksi
ii. Secara instrumental :
- Elektrogravimetri , sampel yang akan dianalisis ditempatkan di
dalam sel elektrolisa. Setelah dilakukan elektrolisis hasil berupa
deposit logam pada katoda dan selanjutnya ditimbang
- Termogravimetri , metode untuk menentukan produk dari
dekomposisi termal untuk memantau massa sampel sebagai
fungsi temperatur sehingga perubahan massa setiap saat dapat
disajikan dalam sebuah grafik.
iii. Metode dengan pengendapan, pada metode ini analit diubah
menjadi endapan, disaring, dicuci hingga bebas pengotor, diubah
menjadi bentuk yang diketahui komponennya, dipanaskan,
dipijarkan dan ditimbang
b. Analisis Volumetri merupakan suatu teknik analisis yang didasarkan
atas pengukuran volumenya larutan :
i. Asidi alkalimetri yaitu titrasi saam basa adalah teknik analisis
berupa titrasi yang didasarkan pada reaksi penetralan suatu asam
oleh basa : Titrasi Asam Kuat dengan Basa Kuat dan Titrasi Asam
Lemah dengan Basa Kuat
ii. Titrasi Redoks (Oksidimetri) adalah titrasi suatu larutan standar
oksidator dengan suatu reduktor atau titrasi yang didasarkan pada
reaksi oksidasi- reduksi antara analit dan titran. Analit yang
mengandung reduktor dititrasi dengan titran yang berupa larutan
standar dari oksidator atau sebaliknya. Terdiri dari :
- Titrasi dengan larutan standar oksidator kuat,misal : MnO 4-,
CrO72- dalam larutan asam, serta I 2 dalam larutan I. Biasanya
digunakan untuk larutan yang mudah dioksidasi
- Titrasi dengan reduktor, misal Fe 2+. Digunakan untuk larutan
yang bersifat oksidator kuat
- Titrasi secara tidak langsung , misal iodometri. Digunakan
untuk larutan yang bersifat oksidator. Untuk menentukan titik
akhir titrasi :
a. Mengikuti titrasi secara potensiometri
b. Titran bertindak sebagai auto-indikator
c. Indikator spesifik adalah suatu zat yang bereaksi secara
spesifik dengan salah satu pereaksi dalam suatu titrasi
sehingga menghasilkan sebuah warna
d. Indikator redoks adalah zat warna yang dapat berubah
warnanya bila direduksi atau dioksidasi. Indikator yang
dipilih harus mempunyai perubahan warna yang dekat
dengan titik ekuivalen titrasi.
Jenis titrasi redoks :
a. Permanganometri adalah titrasi redoks yang menggunakan
titran KMnO4yang merupakan oksidator kuat
b. Iodimetri ( cara langsung) adalah titrasi yang dilakukan
langsung dengan larutan standar iodium sebagai pengoksidasi,
dilakukan dalam suasananetral atau sedikit asam. Iodometri
(tak langsung) zat yang akan ditentukan direaksikan dengan ion
iodida berlebih biasanya digunakan KI berlebih
iii. Titrasi pengendapan (argentometri) adalah titrasi yang didasarkan
pada reaksi pengendapan analit oleh larutan standar titran yang
spesifik mampu mengendapkan analit. Titran yang banyak
digunakan adalah AgNO3. Metode penentuan titik akhir titrasi :
- Mohr : pada metode ini ion kromat bertindak sebagai indikator
yang banyak digunakan untuk titrasi argentometri ion klorida
dan bromida. Titik akhir ditandai dengan terbentuknya endapan
merah bata dari perak kromat
- Volhard : menggunakan larutan standar ion tiosianat untuk
menitrasi ion perak
- Fajans : pada metode ini yang bertindak sebagai indikator
adalah suatu senyawa organik yang dapat diserap pada
permukaan endapan yang terbentuk selama titrasi
berlangsung/dikenal sebagai indikator adsorpsi
iv. Titrasi kompleksometri adalah analisis volumetri yang melibatkan
pembentukan kompleks yang stabil pada reaksi antara
titrat(analit)dengan titran. Ion kompleks adalah agregat bermuatan
poliatomik terdiri dari ion logam yang bermuatan positif
dikombinasikan dengan ligan (molekul netral atau ion negatif).ligan
dapat berupa ion negatif monoatomik (F -, Cl-,Br-) atau molekul
poliatomik (H2O, CN-, SCN-).Jenis titrasi :
- Titrasi yang melibatkan ligan monodentat :
• Titrasi sianida dengan ion perak (Metode Liebig)
• Titrasi ion logam dengan EDTA
- Titrasi komplek EDTA dengan logam. Titrasi ion logam dengan
EDTA dapat dilakukan sebagai berikut :
• titrasi langsung, larutan ion logam yng akan dititrasi diberi
buffer pH tertentu
• titrasi kembali, dilakukan pada logam – logam tertentuyang
tidak dapat dititrasi langsung karena dapat mengendap pada pH
tertentu yang sesuai untuk titrasi sehingga logam tersebut
ditambahkan larutan standar EDTA berlebih kemudian diberi
larutan buffer, lalu kelebihan EDTA dititrasi dengan larutan
standar ion logam.
• titrasi subsitusi, digunakan untuk ion logam yang tidak
bereaksi (kurang bereaksi) dengan indikator logam atau ion
logam yang membentuk kompleks EDTA.
• titrasi alkalimetri
• titrasi tidak langsung
3. Faktor yang mempengaruhi titik akhir titrasi :
a. Konsentrasu
b. kelarutan
4. faktor yang mempengaruhi kurva titrasi :
a. pH larutan
b. harga Kf
5. indikator ion logam adalah suatu zat warna oranik yang membentuk kelat
berwarna dengan ion logam pada rentang tertentu. Beberapa kriteria nya
adalah :
a. ikatan zat warna dengan ion logam harus lebih lemah daripada ikatan
ion logam dengan EDTA
b. perubahan warna harus mudah diamati mata
c. reaksi warna harus spesifik atau selektif
d. harus ada perbedaan jelas antara warna indikator dan warna kompleks
indikator logam. Salah satu indikator logam yang paling banyak
digunakan adalah EBT
KB2. Elektrometri
1. Potensiometri mempelajari hubungan antara konsentrasi larutan dengan
harga potensial listrik dari suatu sel elektrokimia di antara dua elektroda .
Analisis ini memerlukan:
a. elektroda pembanding (reference electroda) merupakan suatu elektroda
yang memiliki harga potensial tetap, konstan dan tidak peka terhadap
komposisi larutan yang sedang diukur
b. elektroda indikator/kerja (indicator /work electrode) yaitu elektroda
yang memiliki nilai potensial yang tergantungpada konsentrasi analit.
Dibagi menjadi dua kategori :
i. elektroda logam meliputi elektroda jenis pertama (menentukan
konsentrasi kation yang berasal dari logamnya), kedua (didasarkan
pada reaksi pengompleksan) dan elektroda redoks (elektroda yang
terbuat dari logam inert seperti Pt dan Au.
ii. Elektroda membran, elektroda ini adapt mementukan ion tertentu
secara selektif. Membran sebagai bahan dasar dipilih karena tidak
mudah keropos, tak larut dalam air dan stabil secara mekanis.
Elektroda membran dibedakan menjadi :
- Elektroda membran kaca, terbuat dari kaca yang digunakan
untuk mengukur pH
- Elektroda membran padat
- Elektroda membran cair, elektroda yang menggunakan senyawa
penukar ion atau carier netral yang dilarutkan dalam pelarut
organik yang tidak bercampur dengan air
- Elektroda sensor gas
c. alat pengukur potensial listrik(voltmeter)
2. peralatan yang digunakan dalam analisis potensiometri meliputi :alat
pengukur potensial, elektroda, tempat analit, magnet pengaduk. Alat
pengukur potensial yang digunakan adalah potensiometer yang
merupakan voltmeter dengan tahanan yang sangat tinggi sehingga arus
listrik tetap terjaga nol dan akibatnya potensial yang terukur relatif stabil.
Terdiri dari dua elektroda yaitu elektroda indikator dan pembanding.
3. Analisis potensiometri dibedakan menjadi :
a. Potensiometri langsung : berdasarkan adanya perbedaan potensial
yang terjadi saat suatu elektroda indikator dicelupkan ke dalam
larutan uji dan saat elektroda indikator dicelupkan ke dalam larutan
standar.
b. Metode standard addition : larutan sampel yang akan dianalisis diukur
potensial selnya lalu dimasukkan sedikit demi sedikit larutan standar
yang telah diketahui konsentrasinya dan diukur potensial selnya
c. Metode sample addition : larutan standar dimasukkan terlebih dahulu
dan larutan yang akan dianalisis dimasukkan kemudian.
4. Contoh analisa potensiometri :
a. analisis ion fluorida dalam pasta gigi,air laut dan air limbah
b. analisis kadar ion kalsium,natrium dan perak dalam air minum
c. analisis kadar nitrat dalam jaringan tumbuhan
d. analisis zat besi dalam darah
5. titrasi potensiometri menggunakan elektroda pembanding, elektroda
indikator dan alat pengukur potensial. Pengukuran potensial dapat
dilakukan secara langsung dengan alat potensiometer atau tidak langsung
melalui pengukuran pH dengan alat pH meter. Titik ekuivalen dapat
ditentukan dengan membuat kurva hubungan antara potensial (volt)
terhadap mL titran.
6. Titrasi kompleksometri dapat dilakukan dengan metode titrasi
potensiometri. Penentuan kadar ion logam M m+ dalam suatu larutan dapat
dilakukan dengan titrasi oleh senyawa pengompleks tertentu, pada
umumnya EDTA
7. Metode analisis secara konduktometri merupakan metode untuk menentukan konsentrasi suatu
larutan berdasarkan pengukuran konduktansi atau daya hantar listriknya. Pengukuran konduktansi
larutan elektrolit diantara dua elektroda yang bersifat inert dapat digunakan untuk mempelajari
hubungan antara konsentrasi dengan daya hantar listrik. Jika perbedaan daya hantar listrik diantara
sebelum dan sesudah penambahan reagen cukup besar maka dapat digunakan untuk mengikuti re
reaksi titrasi yang dikenal sebagai titrasi konduktometri
8. Konduktansi adalah kemampuan suatu media untuk membawa arus
listrik.
9. Titrasi konduktometri merupakan metode untuk menganalisa larutan
berdasarkan kemampuan ion dalam menghantarkan muatanlistrik di
antara dua elektroda melalui tindakan titrasi. Dapat dilakukan melalui
dua cara :
a. Titrasi konduktometri frekuensi arus rendah (300 Hz)
b. Titrasi konduktometri frekuensi tinggi (beberapa mega hertz)
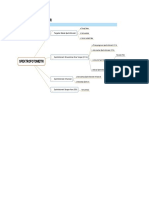
KB 3. Spektrofotometri
1. Spektrofotometri merupakan salah satu metode analisis yang digunakan
untuk menentukan komposisi suatu sampel baik secara kuantitatif dan
kualitatif didasarkan pada interaksi antara radiasi dan materi. Radiasi
yang dimaksud bisa berupa cahaya visibel, UV dan inframerah sedangkan
materi dapat berupa atom dan molekul namun yang lebih berperan adalah
elektron valensi. Analisa ini didasarkan pada spektroskopi.
2. Spektroskopi adalah istilah umum untuk ilmu pengetahuan yang
berhubungan dengan interaksi dari berbagai jenis radiasi dengan materi.
3. Instrumen yang digunakan dalam spektrofotometri terdiri atas beberapa komponen umum, yaitu
sumber energi yang dapat diserap sampel, sarana untuk mengisolasi rentang panjang gelombang
tertentu, detektor untuk mengukur sinyal, dan prosesor sinyal untuk menampilkan sinyal dalam
bentuk yang dapat dianalisis lebih lanjut.
4. Metode spektrofotometer didasarkan pada hukum Lambert – Beer atau
biasanya disebut hukum beer.
5. Prinsip pengukuran spektrofotometri UV – Vis adalah promosi elektron
dari keadaan dasar (ground state) ke keadaan tereksitasi (excited state)
akibat penyerapan sinar UV/ Vis oleh molekul/ion.
6. Instrumen spektrofotometer Uv/Vis meliputi sumber radiasi,
monokromator, kompartemen sampel dan detektor. Sumber radiasi terdiri
dari dua lampu deutreum, lampu tungsten (wolfram) atau lampu merkuri.
7. Lampu tungsten merupakan campuran dari filament tungsten dan gas
iodin(halogen),oleh karena disebut sumber radiasi “tungsten – iodin”
8. Monokromator merupakan alat yang berfungsi mengubah cahaya yang
polikromatk menjadi cahaya monokromatik dengan mendispersikan sinar
ke dalam komponen – komponen panjang gelombangnya yang selanjutnya
akan dipilih oleh celah.
9. Jenis – jenis spektrofotometri UV/Vis :
a. Fotometer filter merupakan instrumen paling sederhana yang sat ini
digunakan untuk penyerapan UV/Vis oleh molekul. Fotometer filter
memiliki jalur optik tunggal antara sumber energi dan detektor
sehingga disebut instrumen single beam.
b. Spektronik 20 menggunakan monokromator yang berfungsi menseleksi
panjang gelombang, menggantikan filter dalam fotometer.
c. Spektrometer UV/Vis double – beam dikembangkan untuk mengatasi
kelemahan sistem single – beam. Pada sistem double – beam
pengontrolan jalur sinar radiasi bergantian antara sampel dan blanko
10. Spektrofotometer Inframerah dilakukan pada daerah cahaya inframerah
tengah yaitu pada panjang gelombang 2,5 -50µm atau bilangan gelombang
4000-200 cm-1. Energi yang dihasilkan oleh radiasi ini Akan menyebabkan
vibrasi atau getaran pada molekul.
a. Instrumentasi spektrofotometer inframerah, terdiri dari komponen :
sumber radiasi, wadah sampel, monokromator, detektor, rekorder
b. Interpretasi spektrum. Signal yang dihasilkan dari detektor kemudian direkam sebagai
spektrum infra merah yang berbentuk puncak-puncak absorbsi. Spektrum infra merah ini
menunjukkan hubungan antara absorbsi dan frekuensi atau bilanqan gelombang atau panjang
gelombang
11. Instrumen Spektrofotometri Serapan Atom
Katoda pada Hollow Cathode Lamp (HCL) terbuat dari logam yang jenisnya
sesuai dengan logam yang akan dianalisis. Anoda terbuat dari logam
wolfram, nikel atau zirkonium.
2 Daftar 1. Statistika, Teknik Sampling dan Validasi Mode
materi
yang sulit
dipahami
di modul
ini
3 Daftar 1. Membedakan uji t multi sample dengan uji t berpasangan
materi
yang
sering
mengalami
miskonsep
si
Anda mungkin juga menyukai
- Laporan Kimia Analitik I Modul ViiiDokumen9 halamanLaporan Kimia Analitik I Modul ViiikhasanjaBelum ada peringkat
- Laporan Kimia Analitik I MODUL VIIDokumen9 halamanLaporan Kimia Analitik I MODUL VIIkhasanjaBelum ada peringkat
- Pembuatan Senyawa KompleksDokumen5 halamanPembuatan Senyawa KompleksMega WatiBelum ada peringkat
- Modul 8Dokumen3 halamanModul 8VitriastutiBelum ada peringkat
- Pembuatan Kalsium Sulfat Dari Batu GampiDokumen6 halamanPembuatan Kalsium Sulfat Dari Batu GampilimaduaBelum ada peringkat
- Reaksi-Reaksi Kimia Senyawa Golongan UtamaDokumen3 halamanReaksi-Reaksi Kimia Senyawa Golongan UtamaNurlaeli NaelulmunaBelum ada peringkat
- SENYAWA_BERBAHAYADokumen6 halamanSENYAWA_BERBAHAYAInda RobayaniBelum ada peringkat
- Laporan Kimia Organik Acara 2 Rima AstaginaDokumen12 halamanLaporan Kimia Organik Acara 2 Rima Astaginalalu zulfikriBelum ada peringkat
- Laporan Praktikum Percobaan III - Cahya Fadilah - 4311418046Dokumen8 halamanLaporan Praktikum Percobaan III - Cahya Fadilah - 4311418046Cahya FadilahBelum ada peringkat
- AnalisaKualitatifDokumen102 halamanAnalisaKualitatifMuhammad Hambari50% (2)
- Analisis Tetapan Hidrolisis dan Hasil Kali KelarutanDokumen15 halamanAnalisis Tetapan Hidrolisis dan Hasil Kali KelarutanSylvia R Tyas100% (1)
- Praktikum Kimia Anorganik Pembuatan Garam RangkapDokumen9 halamanPraktikum Kimia Anorganik Pembuatan Garam RangkapWahyu UswaBelum ada peringkat
- Laporan Kiman FixDokumen16 halamanLaporan Kiman FixYaumil Agus AkhirBelum ada peringkat
- Analisis Kualitatif KationDokumen23 halamanAnalisis Kualitatif KationAnhar RahmawanBelum ada peringkat
- KADAR ASAMDokumen12 halamanKADAR ASAMBrahmani Prita D.Belum ada peringkat
- Ekstraksi PelarutDokumen12 halamanEkstraksi PelarutGitha Jha DechBelum ada peringkat
- Laprak Kimor Acara 1Dokumen11 halamanLaprak Kimor Acara 1Maya MeisariBelum ada peringkat
- KOMPLEKS KU-AMMINDokumen11 halamanKOMPLEKS KU-AMMINagung jayaniBelum ada peringkat
- Analisis Ion SulfatDokumen6 halamanAnalisis Ion SulfatFajrii Adrian NBelum ada peringkat
- Kompleks dan RangkapDokumen11 halamanKompleks dan RangkapvernoniejwwBelum ada peringkat
- Pembahasan Struktur KristalDokumen15 halamanPembahasan Struktur KristalAdelita KhairaniBelum ada peringkat
- Analisis PotensiometriDokumen21 halamanAnalisis PotensiometrijurniatiBelum ada peringkat
- Soal TermodinamikaDokumen2 halamanSoal TermodinamikaYunda EffriantyBelum ada peringkat
- Laporan Akhir - 4 - Golongan Nitrogen Dan Angka PermanganatDokumen17 halamanLaporan Akhir - 4 - Golongan Nitrogen Dan Angka PermanganatAdinda Mirra Rahmani TaufikBelum ada peringkat
- Msds Amina Primer DKKDokumen12 halamanMsds Amina Primer DKKNisaMardiyahBelum ada peringkat
- Analisis ProteinDokumen49 halamanAnalisis ProteinRahmawati Nirmala SariBelum ada peringkat
- UNTUK KONDUKTIVITAS ELEKTROLITDokumen17 halamanUNTUK KONDUKTIVITAS ELEKTROLITMarina FitrianiBelum ada peringkat
- Bunga Pacar AirDokumen16 halamanBunga Pacar Airkemala putriBelum ada peringkat
- Metode Sintesis Dalam Kimia OrganikDokumen7 halamanMetode Sintesis Dalam Kimia OrganikDian Dwi RestuBelum ada peringkat
- Analisis Instrumen POLAROGRAFIDokumen18 halamanAnalisis Instrumen POLAROGRAFICathur Gabriel MBelum ada peringkat
- Percobaan 8Dokumen14 halamanPercobaan 8Grace Patiung100% (1)
- Titrasi Asam Kuat Dan Basa LemahDokumen3 halamanTitrasi Asam Kuat Dan Basa LemahMan NoelBelum ada peringkat
- OPTIMASIDokumen12 halamanOPTIMASICitra Pranata NiagaBelum ada peringkat
- Kimia Organik dan BiomolekulDokumen12 halamanKimia Organik dan BiomolekulM.juliardiBelum ada peringkat
- Ekstraksi Alumina SandiDokumen3 halamanEkstraksi Alumina SandiSandi VicoBelum ada peringkat
- Garam Mohr Tugas Pak Oem KhayDokumen4 halamanGaram Mohr Tugas Pak Oem KhayMega Nurjannah AhmadBelum ada peringkat
- Percb 3 K1A021065 M. Dwi Jefry ArdiansyahDokumen19 halamanPercb 3 K1A021065 M. Dwi Jefry Ardiansyah28M. Dwi Jefry ArdiansyahBelum ada peringkat
- Adsorpsi PareDokumen30 halamanAdsorpsi PareJibril Siapiapi AptBelum ada peringkat
- Laporan Tetap Anstru AriansDokumen63 halamanLaporan Tetap Anstru AriansismyanaBelum ada peringkat
- Soal Sintesis Organik Anorganik 1C-TKI 2016Dokumen24 halamanSoal Sintesis Organik Anorganik 1C-TKI 2016Anti100% (1)
- Laprak TRANSISIDokumen17 halamanLaprak TRANSISIJokoSuswonoBelum ada peringkat
- Laporan Praktikum Percobaan II - Cahya Fadilah - 4311418046Dokumen8 halamanLaporan Praktikum Percobaan II - Cahya Fadilah - 4311418046Cahya FadilahBelum ada peringkat
- Analisa Kandungan Fluorida Dalam Air Di PT. Anugrah An Alis Sempurna, DepokDokumen27 halamanAnalisa Kandungan Fluorida Dalam Air Di PT. Anugrah An Alis Sempurna, DepokadiyosiaBelum ada peringkat
- Worksheet Titrasi Permanganometri 2021Dokumen3 halamanWorksheet Titrasi Permanganometri 2021witriBelum ada peringkat
- Destilasi Normal (Air Tapai)Dokumen4 halamanDestilasi Normal (Air Tapai)DitoAPrasetyo0% (1)
- Graphene oxide aerogel limbah minyakDokumen91 halamanGraphene oxide aerogel limbah minyaknur aprilianaBelum ada peringkat
- TITRASI KONDUKTOMETRI PbDokumen10 halamanTITRASI KONDUKTOMETRI PbColorless MochiBelum ada peringkat
- EksplorasiDokumen15 halamanEksplorasidindashezaria7Belum ada peringkat
- 5246 - Sni 7850-2013 PDFDokumen22 halaman5246 - Sni 7850-2013 PDFDienny N AmaliaBelum ada peringkat
- Mengenal Proses Metalurgi Di PT WHW Alumina Refinery - Muhammad Rizqi Rafi - 19132020Dokumen7 halamanMengenal Proses Metalurgi Di PT WHW Alumina Refinery - Muhammad Rizqi Rafi - 19132020Rizqi RafiBelum ada peringkat
- Kation Group AnalysisDokumen15 halamanKation Group AnalysisZikri ZamalulailBelum ada peringkat
- Pembahasan ElektrogravimetriDokumen4 halamanPembahasan ElektrogravimetriBintang Benarivo MangengkeBelum ada peringkat
- Percobaan IV - Kristal Tunggal Kal (So4) 2Dokumen5 halamanPercobaan IV - Kristal Tunggal Kal (So4) 2Henggar Wahyu SiswantiBelum ada peringkat
- SDHJDokumen12 halamanSDHJRahma RizkaBelum ada peringkat
- Laporan Alat Serap Gas Drain MBO PDFDokumen17 halamanLaporan Alat Serap Gas Drain MBO PDFGelar ArdyanBelum ada peringkat
- BariumDokumen14 halamanBariumRizkiana NurazizahBelum ada peringkat
- Mingguan Acara 5Dokumen11 halamanMingguan Acara 5Yadie SuryadieBelum ada peringkat
- ANALISIS KIMIADokumen11 halamanANALISIS KIMIAhsupratiyoBelum ada peringkat
- Esty Badar - 219033495025 - LK1 - Modul4Dokumen9 halamanEsty Badar - 219033495025 - LK1 - Modul4Esty Badar FauzuliaBelum ada peringkat
- LK 1 - Lembar Kerja Belajar Mandiri Modul 4 Dasar Dasar Kimia AnalisisDokumen13 halamanLK 1 - Lembar Kerja Belajar Mandiri Modul 4 Dasar Dasar Kimia AnalisisSepti RiyanningsihBelum ada peringkat
- Analisa Penerapan Materi Modul 3 - ESTY BADAR FAUZULIA - T.KIM 01 A3Dokumen5 halamanAnalisa Penerapan Materi Modul 3 - ESTY BADAR FAUZULIA - T.KIM 01 A3Esty Badar FauzuliaBelum ada peringkat
- T.Kim 01 A3 - M2Dokumen1 halamanT.Kim 01 A3 - M2Esty Badar FauzuliaBelum ada peringkat
- Analisis Penerapan Materi Modul 5 - Esty Badar Fauzulia - 219033495025Dokumen7 halamanAnalisis Penerapan Materi Modul 5 - Esty Badar Fauzulia - 219033495025Esty Badar FauzuliaBelum ada peringkat
- Silabus Pengetahuan Bahan TekstilDokumen7 halamanSilabus Pengetahuan Bahan Tekstilrosdiana mawardiasih75% (4)
- LK 7. Format PenilaianDokumen3 halamanLK 7. Format PenilaianEsty Badar FauzuliaBelum ada peringkat
- Alat Filtrasi Sederhana Modul Kelas XIDokumen2 halamanAlat Filtrasi Sederhana Modul Kelas XIEsty Badar FauzuliaBelum ada peringkat
- ANALISIS KIMIADokumen4 halamanANALISIS KIMIAEsty Badar FauzuliaBelum ada peringkat
- LK 6. Format LKPDDokumen2 halamanLK 6. Format LKPDEsty Badar FauzuliaBelum ada peringkat
- PROSES GULADokumen7 halamanPROSES GULAEsty Badar FauzuliaBelum ada peringkat
- Materi Ajar SMKDokumen1 halamanMateri Ajar SMKEsty Badar FauzuliaBelum ada peringkat
- Analisis Penerapan Materi Modul 5Dokumen7 halamanAnalisis Penerapan Materi Modul 5Esty Badar FauzuliaBelum ada peringkat
- Tugas Akhir Modul 1Dokumen4 halamanTugas Akhir Modul 1Esty Badar FauzuliaBelum ada peringkat
- Modul 4 LK 1 - Lembar Kerja Belajar MandiriDokumen11 halamanModul 4 LK 1 - Lembar Kerja Belajar MandiriEsty Badar FauzuliaBelum ada peringkat
- c2 Silabus TekstilDokumen23 halamanc2 Silabus TekstilEsty Badar FauzuliaBelum ada peringkat
- BUKTI Miniatur Grinding SizingDokumen2 halamanBUKTI Miniatur Grinding SizingEsty Badar FauzuliaBelum ada peringkat
- KROMATOGRAFI Teknik Pemisahan dan AnalisisDokumen1 halamanKROMATOGRAFI Teknik Pemisahan dan AnalisisEsty Badar FauzuliaBelum ada peringkat
- Peta Konsep Modul 4 KB 4Dokumen1 halamanPeta Konsep Modul 4 KB 4Esty Badar FauzuliaBelum ada peringkat
- LKPD Peer Teaching - T.Kim01 - A3Dokumen9 halamanLKPD Peer Teaching - T.Kim01 - A3Esty Badar FauzuliaBelum ada peringkat
- KB 1Dokumen1 halamanKB 1Esty Badar FauzuliaBelum ada peringkat
- LK 1 Modul 3Dokumen6 halamanLK 1 Modul 3Esty Badar FauzuliaBelum ada peringkat
- Esty Badar - 219033495025 - LK1 - Modul2Dokumen10 halamanEsty Badar - 219033495025 - LK1 - Modul2Esty Badar FauzuliaBelum ada peringkat
- Analisis Penerapan Materi Modul 6 KB2 K3Dokumen7 halamanAnalisis Penerapan Materi Modul 6 KB2 K3Esty Badar FauzuliaBelum ada peringkat
- KB 1Dokumen1 halamanKB 1Esty Badar FauzuliaBelum ada peringkat
- Peta Konsep Modul 4 KB 3Dokumen1 halamanPeta Konsep Modul 4 KB 3Esty Badar FauzuliaBelum ada peringkat
- Silabus Pengetahuan Bahan TekstilDokumen7 halamanSilabus Pengetahuan Bahan Tekstilrosdiana mawardiasih75% (4)
- Uts 2108 PakoDokumen12 halamanUts 2108 PakoNicko FirinBelum ada peringkat
- c2 Silabus TekstilDokumen23 halamanc2 Silabus TekstilEsty Badar FauzuliaBelum ada peringkat
- Modul Bakar Bulu RevDokumen27 halamanModul Bakar Bulu RevEsty Badar FauzuliaBelum ada peringkat
- Resume DikonversiDokumen9 halamanResume DikonversiEsty Badar FauzuliaBelum ada peringkat