Koligatif
Koligatif
Diunggah oleh
Lili RJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Koligatif
Koligatif
Diunggah oleh
Lili RHak Cipta:
Format Tersedia
*Portofolio 1 *
Selasa, 19 Juli 2005
Oleh : Davin Pratama Cahyadi XII. IA.2 / 8
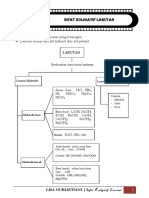
RINGKASAN MATERI PETA KONSEP KIMIA
Peta Konsep
Dari Peta konsep yang terlukiskan diatas maka akan dibuat ringkasan materi sebagai berikut : LARUTAN adalah campuran homogen dua zat atau lebih yang saling melarutkan dan masing-masing zat penyusunnya tidak dapat dibedakan lagi secara fisik. Larutan terdiri atas zat terlarut dan pelarut. Berdasarkan daya hantar listriknya (daya ionisasinya), larutan dibedakan dalam dua macam, yaitu larutan elektrolit dan larutan non elektrolit. Larutan elektrolit adalah larutan yang dapat menghantarkan arus listrik.
/var/www/apps/conversion/tmp/scratch_1/174830394.doc http://www.geocities.com/davinpratama/lapkim/koligatif.doc
*Portofolio 1 * Larutan ini dibedakan atas : 1. ELEKTROLIT KUAT
Selasa, 19 Juli 2005
Larutan elektrolit kuat adalah larutan yang mempunyai daya hantar listrik yang kuat, karena zat terlarutnya didalam pelarut (umumnya air), seluruhnya berubah menjadi ion-ion (alpha = 1). Yang tergolong elektrolit kuat adalah: a. Asam-asam kuat, seperti : HCl, HCl03, H2SO4, HNO3 dan lain-lain. b. Basa-basa kuat, yaitu basa-basa golongan alkali dan alkali tanah, seperti: NaOH, KOH, Ca(OH)2, Ba(OH)2 dan lain-lain. c. Garam-garam yang mudah larut, seperti: NaCl, KI, Al2(SO4)3 dan lain-lain 2. ELEKTROLIT LEMAH Larutan elektrolit lemah adalah larutan yang daya hantar listriknya lemah dengan harga derajat ionisasi sebesar: O < alpha < 1. Yang tergolong elektrolit lemah: a. Asam-asam lemah, seperti : CH3COOH, HCN, H2CO3, H2S dan lain-lain b. Basa-basa lemah seperti : NH4OH, Ni(OH)2 dan lain-lain c. Garam-garam yang sukar larut, seperti : AgCl, CaCrO 4, PbI2 dan lain-lain Larutan non elektrolit adalah larutan yang tidak dapat menghantarkan arus listrik, karena zat terlarutnya di dalam pelarut tidak dapat menghasilkan ion-ion (tidak mengion). Tergolong ke dalam jenis ini misalnya: - Larutan urea - Larutan sukrosa - Larutan glukosa - Larutan alkohol dan lain-lain Konsentrasi merupakan cara untuk menyatakan hubungan kuantitatif antara zat terlarut dan pelarut. Menyatakan konsentrasi larutan ada beberapa macam, di antaranya: 1. FRAKSI MOL (X) Fraksi mol adalah perbandingan antara jumiah mol suatu komponen dengan jumlah mol seluruh komponen yang terdapat dalam larutan. Fraksi mol dilambangkan dengan X.
Xt = mol bag.larutan mol total laruatan
Contoh: Suatu larutan terdiri dari 3 mol zat terlarut A dengan 7 mol zat terlarut B. maka: XA = nA / (nA + nB) = 3 / (3 + 7) = 0.3 XB = nB /(nA + nB) = 7 / (3 + 7) = 0.7 * XA + XB = 1 2. PERSEN BERAT (%)
/var/www/apps/conversion/tmp/scratch_1/174830394.doc http://www.geocities.com/davinpratama/lapkim/koligatif.doc
*Portofolio 1 *
Selasa, 19 Juli 2005
Persen berat menyatakan gram berat zat terlarut dalam 100 gram larutan.
%= bagian larutan x100 total larutan
Contoh: Larutan gula 5% dalam air, artinya: dalam 100 gram larutan terdapat : - gula = 5/100 x 100 = 5 gram - air = 100 - 5 = 95 gram 3. MOLALITAS (m) Molalitas menyatakan mol zat terlarut dalam kg (1000 gram) pelarut.
m= mol terlarut kg(1000gr). pelarut
Contoh: Hitunglah molalitas 4 gram NaOH (Mr = 40) dalam 500 gram air ! - molalitas NaOH = (4/40) / 500 gram air = (0.1 x 2 mol) / 1000 gram air = 0,2 m 4. MOLARITAS (M) Molaritas menyatakan jumlah mol zat terlarut dalam 1 liter larutan.
M = mol terlarut L. larutan
Contoh: Berapakah molaritas 9.8 gram H2SO4 (Mr= 98) dalam 250 ml larutan ? - molaritas H2SO4 = (9.8/98) mol / 0.25 liter = (0.1 x 4) mol / liter = 0.4 M 5.* NORMALITAS (N) Normalitas menyatakan jumlah mol ekivalen zat terlarut dalam 1 liter larutan. Untuk asam, 1 mol ekivalennya sebanding dengan 1 mol ion H +. Untuk basa, 1 mol ekivalennya sebanding dengan 1 mol ion OH-. Antara Normalitas dan Molaritas terdapat hubungan : N = M x valensi
Sifat koligatif larutan adalah sifat larutan yang tidak tergantung pada macamnya zat terlarut tetapi semata-mata hanya ditentukan oleh banyaknya zat terlarut (konsentrasi zat terlarut). Sifat koligatif meliputi: 1. Penurunan tekanan uap jenuh (rP) 2. Kenaikan titik didih (rTb)
/var/www/apps/conversion/tmp/scratch_1/174830394.doc http://www.geocities.com/davinpratama/lapkim/koligatif.doc
*Portofolio 1 *
Selasa, 19 Juli 2005
Tf ) 3. Penurunan titik beku ( 4. Tekanan osmotik ( )
Banyaknya partikel dalam larutan ditentukan oleh konsentrasi larutan dan sifat Larutan itu sendiri. Jumlah partikel dalam larutan non elektrolit tidak sama dengan jumlah partikel dalam larutan elektrolit, walaupun konsentrasi keduanya sama. Hal ini dikarenakan larutan elektrolit terurai menjadi ion-ionnya, sedangkan larutan non elektrolit tidak terurai menjadi ion-ion. Dengan demikian sifat koligatif larutan dibedakan atas sifat koligatif larutan non elektrolit dan sifat koligatif larutan elektrolit.
PENURUNAN TEKANAN UAP JENUH (rP) Pada setiap suhu, zat cair selalu mempunyai tekanan tertentu. Tekanan ini adalah tekanan uap jenuhnya pada suhu tertentu. Penambahan suatu zat ke dalam zat cair menyebabkan penurunan tekanan uapnya. Hal ini disebabkan karena zat terlarut itu mengurangi bagian atau fraksi dari pelarut, sehingga kecepatan penguapanberkurang. Menurut RAOULT: p = po . XB dimana: p = tekanan uap jenuh larutan po = tekanan uap jenuh pelarut murni XB = fraksi mol pelarut Karena XA + XB = 1, maka persamaan di atas dapat diperluas menjadi: P = Po (1 - XA) P = Po - Po . XA Po - P = Po . XA sehingga: rP = po . XA dimana: rP = penunman tekanan uap jenuh pelarut po = tekanan uap pelarut murni XA = fraksi mol zat terlarut Contoh: Hitunglah penurunan tekanan uap jenuh air, bila 45 gram glukosa (Mr = 180) dilarutkan dalam 90 gram air ! Diketahui tekanan uap jenuh air murni pada 20oC adalah 18 mmHg.
Jawab:
/var/www/apps/conversion/tmp/scratch_1/174830394.doc http://www.geocities.com/davinpratama/lapkim/koligatif.doc
*Portofolio 1 * mol glukosa = 45/180 = 0.25 mol mol air = 90/18 = 5 mol fraksi mol glukosa = 0.25/(0.25 + 5) = 0.048 Penurunan tekanan uap jenuh air: rP = Po. XA = 18 x 0.048 = 0.864 mmHg KENAIKAN TITIK DIDIH (rTb)
Selasa, 19 Juli 2005
Adanya penurunan tekanan uap jenuh mengakibatkan titik didih larutan lebih tinggi dari titik didih pelarut murni. Untuk larutan non elektrolit kenaikan titik didih dinyatakan dengan: rTb = m . Kb dimana: rTb = kenaikan titik didih (oC) m = molalitas larutan Kb = tetapan kenaikan titik didih molal Karena : m = (W/Mr) . (1000/p) ; (W menyatakan massa zat terlarut) Maka kenaikan titik didih larutan dapat dinyatakan sebagai: rTb = (W/Mr) . (1000/p) . Kb Apabila pelarutnya air dan tekanan udara 1 atm, maka titik didih larutan dinyatakan sebagai: Tb = (100 + rTb)oC
Tf ) PENURUNAN TITIK BEKU (
Untuk penurunan titik beku persamaannya dinyatakan sebagai : rTf = m . Kf = W/Mr . 1000/p . Kf dimana: rTf = penurunan titik beku m = molalitas larutan Kf = tetapan penurunan titik beku molal W = massa zat terlarut Mr = massa molekul relatif zat terlarut p = massa pelarut Apabila pelarutnya air dan tekanan udara 1 atm, maka titik beku larutannya dinyatakan sebagai: Tf = (O - rTf)oC Tabel Tetapan kenaikan Titik didih Molal (Kb) dan Tetapan penurunan Titik Beku Molal (Kf) dari beberapa Pelarut (tekanan 1 atm)
/var/www/apps/conversion/tmp/scratch_1/174830394.doc http://www.geocities.com/davinpratama/lapkim/koligatif.doc
*Portofolio 1 *
Selasa, 19 Juli 2005
Titik Didih (oC) 100,0 118,3 80,20 61,20 Titik Beku (oC) 0,00 16,6 5,45 -
Pelarut Air Asan asetat Benzena Klorofrom
Kb 0,52 3,07 2,53 2,63
Kf 1,86 3,57 5,07 -
TEKANAN OSMOTIK ( ) Tekanan osmotik adalah tekanan yang diberikan pada larutan yang dapat menghentikan perpindahan molekul-molekul pelarut ke dalam larutan melalui membran semi permeabel (proses osmosis).
Menurut VAN'T Hoff tekanan osmotik mengikuti hukum gas ideal: PV = nRT Karena tekanan osmotik =
, maka :
= n/V R T = C R T
dimana : = tekanan osmotik (atmosfir) C = konsentrasi larutan (mol/liter= M) R = tetapan gas universal = 0.082 liter.atm/moloK T = suhu mutlak (oK) - Larutan yang mempunyai tekanan osmotik lebih rendah dari yang lain disebut larutan Hipotonis. - Larutan yang mempunyai tekanan osmotik lebih tinggi dari yang lain disebut larutan Hipertonis. - Larutan-larutan yang mempunyai tekanan osmotik sama disebut Isotonis. Seperti yang telah dijelaskan sebelumnya bahwa larutan elektrolit di dalam pelarutnya mempunyai kemampuan untuk mengion. Hal ini mengakibatkan larutan elektrolit mempunyai jumlah partikel yang lebih banyak daripada larutan non elektrolit pada konsentrasi yang sama.
/var/www/apps/conversion/tmp/scratch_1/174830394.doc http://www.geocities.com/davinpratama/lapkim/koligatif.doc
*Portofolio 1 *
Selasa, 19 Juli 2005
Contoh: Larutan 0.5 molal glukosa dibandingkan dengan iarutan 0.5 molal garam dapur. - Untuk larutan glukosa dalam air jumlah partikel (konsentrasinya) tetap, yaitu 0.5 molal. - Untuk larutan garam dapur: NaCl(aq) --> Na+ (aq) + Cl- (aq) karena terurai menjadi 2 ion, maka konsentrasi partikelnya menjadi 2 kali semula = 1.0 molal. Yang menjadi ukuran langsung dari keadaan (kemampuannya) untuk mengion adalah derajat ionisasi. Besarnya derajat ionisasi ini dinyatakan sebagai: = jumlah mol zat yang terionisasi/jumlah mol zat mula-mula
=
jumlah mol zat yang terionisasi jumlah mol zat mula - mula
Untuk larutan elektrolit kuat, harga derajat ionisasinya mendekati 1, sedangkan untuk elektrolit lemah, harganya berada di antara 0 dan 1 (0 < < 1). Atas dasar kemampuan ini, maka larutan elektrolit mempunyai pengembangan di dalam perumusan sifat koligatifnya sebagai berikut: Faktor Vant Hoff(i) i = [1+ (n-1)] 1.) Untuk Kenaikan Titik Didih dinyatakan sebagai: rTb = m . Kb [1 + (n-1)] = W/Mr . 1000/p . Kb [1+ (n-1)] n menyatakan jumlah ion dari larutan elektrolitnya. 2.) Untuk Penurunan Titik Beku dinyatakan sebagai: rTf = m . Kf [1 + (n-1)] = W/Mr . 1000/p . Kf [1+ (n-1)] 3.) Untuk Tekanan Osmotik dinyatakan sebagai: = C R T [1+ (n-1)] 4.) Untuk penurunan tekanan uap (rP) dinyatakan sebagai: rP = po . XA. [1+ (n-1)] Contoh: Hitunglah kenaikan titik didih dan penurunan titik beku dari larutan 5.85 gram garam dapur (Mr = 58.5) dalam 250 gram air ! (bagi air, Kb= 0.52 dan Kf= 1.86) Jawab: Larutan garam dapur, NaCl(aq) --> NaF+ (aq) + Cl- (aq) Jumlah ion = n = 2. rTb = 5.85/58.5 x 1000/250 x 0.52 [1+1(2-1)] = 0.208 x 2 = 0.416 oC
/var/www/apps/conversion/tmp/scratch_1/174830394.doc http://www.geocities.com/davinpratama/lapkim/koligatif.doc
*Portofolio 1 *
Selasa, 19 Juli 2005
rTf = 5.85/58.5 x 1000/250 x 0.86 [1+1(2-1)] = 0.744 x 2 = 1.488 oC Catatan: Jika di dalam soal tidak diberi keterangan mengenai harga derajat ionisasi, tetapi kita mengetahui bahwa larutannya tergolong elektrolit kuat, maka harga derajat ionisasinya dianggap 1.
SUMBER REFERENSI :
1. 2. 3. 4. Peta Konsep oleh pak Wayan Soma Rahasia penerapan Rumus-rumus kimia oleh Drs. Taman MASTER KIMIA oleh Sri Wahyuni Intisari KIMIA untuk SMU oleh Dedi Permana 5. Internet (www.e-dukasi.com), ( www.chem-is-try.net ), (www.google.co.id), dll 6. Forum Pendidikan Telkom, Internet (www.plasa.com/ksi), (www.brawijaya.ac.id)
7. http://digilib.brawijaya.go.id/ library/mlg_warintek/ristek-pdii-lipi/Sponsor/_SponsorPendamping/Praweda/Chemistry/0184%20Kim%202-1b.htm
8. Petrucci, R.H.malih bahasa Suminar Achmadi(1999) Kimia dasar, prinsip dan Terapan Modrn. Edisi keempat. Jilid 2. Jakarta:Erlangga (*Dalam Ringkasan Peta Konsep Kimia ini menggunakan contoh agar lebih mudah di mengerti)
/var/www/apps/conversion/tmp/scratch_1/174830394.doc http://www.geocities.com/davinpratama/lapkim/koligatif.doc
Anda mungkin juga menyukai
- Instrumen Akreditasi 2023 TerbaruDokumen32 halamanInstrumen Akreditasi 2023 TerbaruMuhammad Ikhsan100% (58)
- (Contoh) Surat Pernyataan Keabsahan Dan Kebenaran DokumenDokumen1 halaman(Contoh) Surat Pernyataan Keabsahan Dan Kebenaran DokumenMuhammad Ikhsan100% (5)
- Kimia 1Dokumen13 halamanKimia 1fadhelBelum ada peringkat
- Ringkasan Materi Peta Konsep KimiaDokumen8 halamanRingkasan Materi Peta Konsep KimiaFajar SetiawanBelum ada peringkat
- KoligatifDokumen4 halamanKoligatifArdhi OmenBelum ada peringkat
- Kimia (Arlita Kusuma Dewi XII PSIA 3)Dokumen39 halamanKimia (Arlita Kusuma Dewi XII PSIA 3)Arlita Kusuma DewiBelum ada peringkat
- Sifat Koligatif & KSPDokumen15 halamanSifat Koligatif & KSPAlmer SudhiartaBelum ada peringkat
- Sifat Koligatif Elektrolit Dan Non ElektrolitDokumen30 halamanSifat Koligatif Elektrolit Dan Non ElektrolitLazuardi HidayatBelum ada peringkat
- Sifat Koligatif Elektrolit Dan Non ElektrolitDokumen22 halamanSifat Koligatif Elektrolit Dan Non ElektrolitMelati sukmaBelum ada peringkat
- Sifat Koligatif Elektrolit Dan NonelektrolitDokumen33 halamanSifat Koligatif Elektrolit Dan NonelektrolitNaila Zaskia ArafahBelum ada peringkat
- Sifat Koligatif LarutanDokumen13 halamanSifat Koligatif LarutanArissBelum ada peringkat
- Sifat Koligatif Elektrolit Dan Non ElektrolitDokumen30 halamanSifat Koligatif Elektrolit Dan Non ElektrolitwelydahBelum ada peringkat
- 1 Sifat Koligatif Elektrolit Dan Non ElektrolitDokumen30 halaman1 Sifat Koligatif Elektrolit Dan Non ElektrolitDragon BlackBelum ada peringkat
- Bab 1 Sifat KoligatisDokumen34 halamanBab 1 Sifat KoligatisBintang SaputraBelum ada peringkat
- Sifat Koligatif LarutanDokumen30 halamanSifat Koligatif Larutanadwaa dzakiaBelum ada peringkat
- Kak DindaDokumen28 halamanKak DindaNur HidayahBelum ada peringkat
- KkimiaDokumen17 halamanKkimiakarina ameliaBelum ada peringkat
- Modul Sifat Koligatif Larutan Kimia Kelas XII PDFDokumen34 halamanModul Sifat Koligatif Larutan Kimia Kelas XII PDFakbar vykoBelum ada peringkat
- Larutan LanjutanDokumen17 halamanLarutan LanjutanAndi Reskianti WardaniBelum ada peringkat
- La RutanDokumen34 halamanLa Rutanwiratgoru69Belum ada peringkat
- Bundelan KFDokumen18 halamanBundelan KFsriqadriBelum ada peringkat
- Sifat Koligatif Larutan Teori SingkatDokumen6 halamanSifat Koligatif Larutan Teori SingkatNiee Ciijollejotte JebelindBelum ada peringkat
- Sifat Koligatif Elektrolit Dan Non ElektrolitDokumen30 halamanSifat Koligatif Elektrolit Dan Non Elektrolithanif nurul mushoffaBelum ada peringkat
- Perangkat Pembelajaran-HibridDokumen11 halamanPerangkat Pembelajaran-Hibridcadanganakunarlin.00Belum ada peringkat
- Soal KoligatifDokumen9 halamanSoal KoligatifFitria Puspita100% (1)
- RPP Kimia 1.1 Kelas XiiDokumen11 halamanRPP Kimia 1.1 Kelas Xiisiti67% (3)
- Kemolalan Dan Fraksi MolDokumen5 halamanKemolalan Dan Fraksi MolLailatul Dewi MasthuroBelum ada peringkat
- Tugas Kimia Fisika (1) Raihan RamadhanDokumen10 halamanTugas Kimia Fisika (1) Raihan RamadhanPuspa IndahBelum ada peringkat
- Sifat Koligatif LarutanDokumen7 halamanSifat Koligatif LarutanNensi MarianaBelum ada peringkat
- Sifat Koligatif LarutanDokumen6 halamanSifat Koligatif LarutanTianBelum ada peringkat
- Sifat Koligatif LarutanDokumen4 halamanSifat Koligatif LarutanRusty'na Hasan EffendyBelum ada peringkat
- Laporan Praktikum Kimia Dasar I Titik BekuDokumen22 halamanLaporan Praktikum Kimia Dasar I Titik BekuIndira dwi wahyuniBelum ada peringkat
- Asam BasaDokumen29 halamanAsam Basaaiz rahminawatiBelum ada peringkat
- Sifat Koligatif LarutanDokumen15 halamanSifat Koligatif LarutanInsanestuBelum ada peringkat
- Kimia Terapan - Larutan PDFDokumen21 halamanKimia Terapan - Larutan PDFBahrul Amin100% (1)
- LKPD Konsentrat & Tek UapDokumen89 halamanLKPD Konsentrat & Tek UapAnonymous fpUdSJOBelum ada peringkat
- Sifat Koligatif Elektrolit Dan NonelektrolitDokumen29 halamanSifat Koligatif Elektrolit Dan NonelektrolitAnnisa Septian NurkhasanahBelum ada peringkat
- Sifat Koligatif LarutanDokumen50 halamanSifat Koligatif LarutanLUSPI MINDAH XII MIPA 5Belum ada peringkat
- Modul Kimia Kelas XiiDokumen117 halamanModul Kimia Kelas XiiAulia Bathari anjaniBelum ada peringkat
- Farmasi Fisik KelarutanDokumen16 halamanFarmasi Fisik KelarutanNoviBelum ada peringkat
- KIMIAAAAADokumen8 halamanKIMIAAAAAFarrah AzizaBelum ada peringkat
- Kimia KoligatifDokumen20 halamanKimia KoligatifVincentBelum ada peringkat
- La RutanDokumen12 halamanLa RutanPeni dwiasBelum ada peringkat
- Larutan Dan KelarutanDokumen63 halamanLarutan Dan Kelarutannenjel putriBelum ada peringkat
- Materi Sifat Koligatif Larutan Dan Contoh SoalnyaDokumen6 halamanMateri Sifat Koligatif Larutan Dan Contoh SoalnyaHakamBelum ada peringkat
- Bab 1 Sifat-Sifat Koligatif LarutanDokumen30 halamanBab 1 Sifat-Sifat Koligatif Larutanmuhammar sulthanBelum ada peringkat
- Larutan Dan ZatDokumen27 halamanLarutan Dan ZatRau LndsBelum ada peringkat
- Koligatif LarutanDokumen46 halamanKoligatif LarutanDheta CriesnaBelum ada peringkat
- KimiaDokumen14 halamanKimiaWilmar Ghatan Al-RifqiBelum ada peringkat
- LarutanDokumen78 halamanLarutanHadi Maulana HamzahBelum ada peringkat
- Tekanan Osmotik FIXxDokumen22 halamanTekanan Osmotik FIXxEndah Tri HandayaniBelum ada peringkat
- Materi Kimia Kls 12 by Michael HendrikoDokumen78 halamanMateri Kimia Kls 12 by Michael HendrikoNita RisdianitaBelum ada peringkat
- XII SMT 1Dokumen57 halamanXII SMT 1Nur JayaBelum ada peringkat
- Larutan, Konsentrasi Larutan, Dan Sifat Koligatif Larutan - General Chemistry For Senior High School StudentsDokumen11 halamanLarutan, Konsentrasi Larutan, Dan Sifat Koligatif Larutan - General Chemistry For Senior High School StudentsErman Permana Raja Guk GukBelum ada peringkat
- Sifat Koligatif LarutanDokumen9 halamanSifat Koligatif LarutanEndoraza NuralamBelum ada peringkat
- Tugas TikDokumen17 halamanTugas TikT Ara AgathaBelum ada peringkat
- Sifat KoligatifDokumen23 halamanSifat KoligatiffikarakhmalindaBelum ada peringkat
- (Format) Laporan Bulanan Promkes Rekapitulasi Laporan Upaya Kesehatan Berbasis MasyarakatDokumen2 halaman(Format) Laporan Bulanan Promkes Rekapitulasi Laporan Upaya Kesehatan Berbasis MasyarakatMuhammad IkhsanBelum ada peringkat
- Kuesioner Dan Data IKMDokumen12 halamanKuesioner Dan Data IKMMuhammad IkhsanBelum ada peringkat
- Contoh Surat Pemberhentian Pembayaran Gaji (Fix)Dokumen1 halamanContoh Surat Pemberhentian Pembayaran Gaji (Fix)Muhammad IkhsanBelum ada peringkat
- Format Laporan Promosi Kesehatan Data Kemitraan Bidang KesehatanDokumen2 halamanFormat Laporan Promosi Kesehatan Data Kemitraan Bidang KesehatanMuhammad Ikhsan100% (1)
- Surat PErmohonan SIADokumen2 halamanSurat PErmohonan SIAMuhammad IkhsanBelum ada peringkat
- Formulir Pemantauan Pertumbuhan Balita Di PosyanduDokumen2 halamanFormulir Pemantauan Pertumbuhan Balita Di PosyanduMuhammad IkhsanBelum ada peringkat
- Ceklist Pemeriksaan APAR Di PuskesmasDokumen2 halamanCeklist Pemeriksaan APAR Di PuskesmasMuhammad Ikhsan100% (4)
- Formulir Pemantauan Ibu Hamil EPPGBMDokumen2 halamanFormulir Pemantauan Ibu Hamil EPPGBMMuhammad IkhsanBelum ada peringkat
- (Format) Laporan Bulanan Promkes Puskesmas Kegiatan Kesehatan Usia SekolahDokumen2 halaman(Format) Laporan Bulanan Promkes Puskesmas Kegiatan Kesehatan Usia SekolahMuhammad IkhsanBelum ada peringkat
- Surat Penyataan Tidak Merubah DenahDokumen1 halamanSurat Penyataan Tidak Merubah DenahMuhammad IkhsanBelum ada peringkat
- Surat PErmohonan SIADokumen2 halamanSurat PErmohonan SIAMuhammad IkhsanBelum ada peringkat
- Surat Permohonan Izin PRaktek Apoteker (SIPA)Dokumen2 halamanSurat Permohonan Izin PRaktek Apoteker (SIPA)Muhammad Ikhsan100% (1)
- FORMULIR WALK THROUGH AUDIT (WTA) BPJS KesehatanDokumen1 halamanFORMULIR WALK THROUGH AUDIT (WTA) BPJS KesehatanMuhammad Ikhsan100% (12)
- ResepDokumen1 halamanResepMuhammad IkhsanBelum ada peringkat
- Surat Pernyataan Memiliki Praktek BersamaDokumen1 halamanSurat Pernyataan Memiliki Praktek BersamaMuhammad IkhsanBelum ada peringkat
- Surat Pengantar Laporan AbsenDokumen1 halamanSurat Pengantar Laporan AbsenMuhammad IkhsanBelum ada peringkat
- Macam Macam Tarian IndonesiaDokumen10 halamanMacam Macam Tarian IndonesiaMuhammad IkhsanBelum ada peringkat
- Laporan Bulanan KustaDokumen4 halamanLaporan Bulanan KustaMuhammad IkhsanBelum ada peringkat
- Sop Pengarahan Kepala Puskesmas Maupun PJ ProgramDokumen2 halamanSop Pengarahan Kepala Puskesmas Maupun PJ ProgramMuhammad Ikhsan0% (1)
- (Tugas Kuliah) Makalah BioakustikDokumen21 halaman(Tugas Kuliah) Makalah BioakustikMuhammad Ikhsan100% (1)
- Asuhan Keperawatan Gangguan Volume CairanDokumen14 halamanAsuhan Keperawatan Gangguan Volume CairanMuhammad IkhsanBelum ada peringkat
- Laporan Pendahuluan Fraktur, Askep FrakturDokumen13 halamanLaporan Pendahuluan Fraktur, Askep FrakturMuhammad IkhsanBelum ada peringkat
- Intervensi Pasien Dengan GIPSDokumen6 halamanIntervensi Pasien Dengan GIPSMuhammad IkhsanBelum ada peringkat
- Silabus AkperDokumen3 halamanSilabus AkperMuhammad IkhsanBelum ada peringkat
- Sistem IntegumentDokumen5 halamanSistem IntegumentKoizora She SakurakuBelum ada peringkat