Stoikiometri dan Konsep Mol
Diunggah oleh
Amalina Devi KasturiJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Stoikiometri dan Konsep Mol
Diunggah oleh
Amalina Devi KasturiHak Cipta:
Format Tersedia
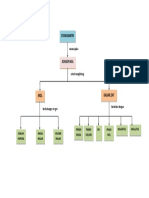
PETA KONSEP
1
STOIKIOMETRI
A. KONSEP MOL
Jumlah permen dalam stoples dapat diketahui jika berat dari satu permen dan
seluruh permen diketahui. Cara itu digunakan ahli kimia untuk menentukan
sejumlah zat-zat atau jumlah partikel pada unsur atau senyawa.
2
Tujuan Pembelajaran:
iswa dapat menghitung jumlah mol suatu zat
iswa dapat mengon!ersikan jumlah mol dengan
jumlah partikel zat
iswa dapat menentukan massa suatu zat
iswa dapat menghitung !olume suatu zat
"alam kehidupan sehari-hari dikenal adanya beberapa satuan jumlah zat
sebagai alat transaksi# misalnya 1 kodi untk 2$ lembar kain# 1 lusin untuk 12 buah
benda# 1 rim untuk %$$ lembar kertas# dsb. &kan tetapi ada zat-zat yang tidak
mungkin menggunakan satuan jumlah tetapi satuan massa# misalnya 1 kg beras# 1
liter minyak goring. 'engapa( )arena tidak mungkin seeorang akan menghitung
dalam jumlah yang banyak sema*am butiran beras# tetesan minyak# atau jumlah 1
truk ka*ang tanah. "apat dibayangkan bila seseorang membeli 1$$$ butir beras di
pasar# berapa lama menghitungnya(
eperti halnya beras# ka*ang tanah# dan gula# atom merupakan partikel
yang sangat ke*il. Jadi tidak mungkin menghitung atom dalam bilangan butir dan
tidak mungkin pula menimbang dalam bilangan butir# tetapi juga tidak mungkin
untuk menimbang beberapa butir atom.
+at-zat yang terlibat dalam reaksi kimia tersebut mengandung partikel-
partikel seperti atom# molekul# atau ion. ,ayangkanlah bahwa 1 gram besi
mengandung lebih dari 1$
2$
butir-butir atom besi dan 1 m- air mengandung lebih
dari 1$
2$
molekul air# jadi sangat sulit menghitungnya.
.kuran sangat ke*il yang dimiliki atom tidak mungkin digunakan dalam
satuan lusin# kodi atau rim. .ntuk alasan kepraktisan# maka dalam menentukan
ukuran jumlah partikel# para ahli kimia sepakat men*ari satuan yang mudah
digunakan# yaitu satuan jumlah yang disebut mol. ,agaimanan menentukan mol
suatu zat(
1. /ubungan 'ol dengan Partikel
atu mol adalah sejumlah partikel yang terkandung di dalam suatu zat
yang jumlahnya sama dengan banyaknya atom yang terdapat di dalam 12
gram C-12. "ari per*obaan yang dilakukan oleh joseph -os*hmidt dan
kemudian dibenarkan oleh &!ogadro# ternyata banyakanya atom karbon yang
terdapat dalam 12 gram C-12 adalah 0#$2 1 1$
22
butir atom. ,ilangan ini
selanjutnya disebut bilangan &!ogadro dan diberi lambang 3.
2
1 mol atom = 6,022 x 10
23
partikel atom
1 mol se!a"a = 6,022 x 10
23
partikel se!a"a
Jadi# jumlah partikel dapat dihitung dengan mengalikan mol dan
tetapan &!ogadro# seperti:
,erikut merupakan sebuah gambaran dari satu mol atom 4# 3e# Cl.
)eterangan : ,ila atom-atom dapat ditempatkan dalam suatu wadah
dan bila besarnya atom adalah sesuai dengan gambar diatas# maka akan
banyak sekali diperlukan wadah untuk menampung atom-atom satu mol.
"alam gambar diatas berhubung jumlah
15
4 banyak sekali sedangkan
16
4
sedikit sekali maka atom-atom 4 diperlihatkan sama. Pada neon# kira-kira ada
satu dari setiap 1$ atom# merupakan isotop terbesar#
22
3e. Pada Clor se*ara
kasar 7 atom adalah
2%
Cl dan 8 adalah
25
Cl.
'ol ditentukan dengan membagi jumlah partikel dengan tetapan
&!ogadro. .ntuk mengubah satuan mol ke jumlah partikel aau sebaliknya
dapat digunakan *ara seperti berikut.
2. /ubungan 'ol dengan 'assa
.ntuk melakukan reaksi dengan tepat# biasanya dilakukan pengukuran
terhadap massa zat-zat yang akan direaksikan. &dakah hubungan massa zat
dengan konsep mol(
,erdasarkan hasil eksperimen dalam 12 gram karbon-12 terdapat 0#$2
1 1$
22
atom karbon. &tom karbon yang jumlahnya 0#$2 1 1$
22
ini sama dengan
1 mol karbon# berarti 1 mol karbon memiliki massa 12 gram. 'assa 1 mol
karbon disebut massa molar karbon. &rC 9 12# maka massa molar karbon
:
# = x L
sama dengan &rC yang dinyatakan dalam gram. ehingga massa molar adalah
massa zat itu yang sama dengan massa atom atau massa rumus zat tersebut
yang dinyatakan dalam gram;mol.
"ari kedua rumusan di atas dapat di*ari hubungan antara massa#
jumlah mol# dan rumus massa atom atau massa molekul relati!e <&r atau 'r=
suatu zat.
'assa zat & 9 mol & 1 'r &
'ol & 9
,isa juga menggunakan rumus:
2. /ubungan 'ol dengan >olum +at
>olum molar gas menyatakan !olum 1 mol gas pada suhu dan tekanan
tertentu. Jika pengukuran dilakukan pada suhu $C dan tekanan 1 atm# !olum
molar gas disebut sebagai !olum molar standar# hal itu disebabkan keadaan
TP <tandard Temperature and Preasure=. Pada keadaan standar# !olum 1
mol gas adalah 22#: liter.
%
Massa 1 mol A = $Ar A% &ram
Massa 1 mol A' = $Mr A'% &ram
m = x Mr
(
STP
= x 22,)
-;mol
n9
'enurut &!ogadro# pada suhu dan tekanan yang sama# gas-gas
ber!olum sama akan mengandung jumlah molekul yang sama pula. &rtinya#
pada suhu dan tekanan yang sama# gas-gas dengan jumlah molekul yang sama
akan mempunyai !olum yang sama pula. 4leh karena 1 mol setiap gas
mempunyai jumlah molekul sama yaitu 0#$2 1 1$
22
molekul# maka pada suhu
dan tekanan yang sama# 1 mol setiap gas mempunyai !olum yang sama. Jadi#
pada suhu dan tekanan yang sama# !olum gas hanya bergantung pada jumlah
molnya.
"irumuskan :
dengan :
V 9 !olum gas
n 9 jumlah mol atau
m
V 9 !olum molar
"ari pembahasan tetapan &!ogadro# mol# massa molar# dan !olum
molar# semuanya dapat dihubungkan dengan bantuan &r atau 'r. 'ol
merupakan terminal untuk mengubah suatu satuan menjadi satuan lain.
/ubungan ini dapat digambarkan sebagai berikut.
"alam mengubah mol menjadi massa# !olum# dan jumlah partikel
digunakan tanda kali <1=. "alam mengubah massa# !olum# dan jumlah partikel
menjadi mol# digunakan tanda bagi <:=.
0
m
V x n V =
1. Tentukan jumlah atom besi yang terdapat dalam $#% mol besi.
Penyelesaian:
Jumlah atom besi 9 $#% mol 1 0#$2 .1$
22
atom mol
?1
9 2#$1.1$
22
atom
2. ,erapakah massa dari 2 mol glukosa C0/1240 <&rC 9 12# / 9 1# 4 9
10=(
Penyelesaian:
'r C0/1240 9 16$
'assa 2 mol glukosa 9 2 mol 1 9 20$ gram
Jadi# massa dari 2 mol glukosa 9 20$ gram
2. ,erapa mol gas C4
2
terdapat di dalam %0$$ m-@
Penyelesaian:
%0$$m- 9 - 9 %#0 -
'ol 9
'ol C42 9 9 $#2% mol
5
*oto+ Soal
'. ,-K-M . ,-K-M TENTAN/ /AS
"alam teoria tomnya# John "alton mengatakan bahwa senyawa terbentuk
dari dua jenis atom atau lebih dengan perbandingan tertentu. 3amun demikian#
pada masa itu# para ahli belum mengetahui *ara menentukan rumus kimia zat.
"alton bahkan pernah menyatakan rumus kimia air sebagai /4 karena
menganggap bahwa unsure-unsur selalu terdiri dari atom-atom dan bahwa
senyawa merupakan penggabungan sederhana dari atom-atom unsur. Cara
menentukan rumus kimia zat bisa dilakukan setelah penemuan Aay -ussa* dan
&!ogadro.
1. /ukum Aas Bdeal
/enry Ca!ebdish <1521-161$=# seorang ahli kima berkebangsaan
Bnggris# menemukan Cakta bahwa perbandingan !olum hidrogan : !olum
oksigen dalam membentuk air adalah 2 : 1# dengan syarat kedua gas itu diukur
pada suhu <T= dan tekanan <P= yang sama. Pada tahun 16$D# Joseph -ouis Aay
-ussa* <1556-16%$= asal peran*is tertarik pada penemuan tersebut# kemudian
melakukan per*obaan terhadap berbagai reaksi gas dan menemukan hasil
sebagai beriku.
6
Sis"a 0apat mem12ktika 1erlak2!a +ipotesis
A3o&a0ro
Sis"a 0apat meem2ka +212&a atara tekaa,
s2+2, 0a 3ol2me 0ari s2at2 &as pa0a kea0aa
tertet2 pa0a +2k2m /as 40eal
a. Pada reaksi antara gas hydrogen dengan gas klorin membentuk gas
hydrogen klorida# perbandingan !olumenya adalah 1 : 1 : 2
b. Pada reaksi antara gas hydrogen dengan gas oksigen membentk uap air#
perbandingan !olumenya adalah 2 : 1 : 2
*. Pada reaksi antara gas nitrogen dengan gas hydrogen membentuk
ammonia# perbandingan !olumnya 1 : 2 : 2
Aay -ussa* menyimpulkan penemuannya daam suatu hukum yang disebut
hukum perbandingan !olum# sebagai berikut. E,ila diukur pada suhu dan
tekanan yang sama# !olum gas yang bereaksi dan gas hasil reaksi berbanding
sebagai bilangan bulat dan sederhanaF.
,ila suatu gas dipanaskan maka akan terjadi pemuaian !olum. &danya
pemuaian !olum menyebabkan terjadinya penyimpangan-penyimpangan pada
hukum-hukum yang berlaku pada gas. .ntuk gas ideal dianggap bahwa tidak
ada penyimpangan-penyimpangan tersebut. ,eberapa hukum tentang gas yang
berlaku pada gas ideal adalah:
1. /ukum ,oyle# EPada suhu tetap dan jumlah mol tetap# berlaku PG1;>F
2. /ukum &monton# EPada !olum dan jumlah mol tetap# maka PGTF
2. /ukum Charles# EPada tekanan dan jumlah mol tetap# maka >GTF
:. /ipotesis &!ogadro EPada tekanan dan suhu tetap# maka >GnF
"ari keempat hukum tersebut dapat disimpulkan bahwa pada gas ideal
berlaku persamaan:
"engan#
P 9 tekanan <atm= n 9 jumlah mol <mol=
T 9 suhu mutlak <$)= H 9 Tetapan gas ideal <$#$62 - atm;) mol=
> 9 >olum <-=
2. /ipotesis &!ogadro
D
P( = 5 T
/ipotesis &!ogadro menyatakan bahwa# Pada suhu dan tekanan
yang sama# sejumlah !olume yang sama suatu gas <sembarang gas=
mengandung jumlah molekul yang sama pula. ,erdasarkan pernyataan
tersebut berarti apabila jumlah molekul sama# maka jumlah mol gas akan sama
pula. "engan demikian berlaku bahwa perbandingan !olum gas akan sama
dengan perbandingan mol gas.
1. /itung !olum % mol gas pada tekanan 1%2 mm /g dan temperatur 25 rC@
Penyelesaian:
"iketahui: P 9 1%2 mm/g 9 $#2 atmI T 9 25 J 252 9 2$$ )
P> 9 nHT
$#2 atm 1 > 9 % mol 1 $#$62 - atm mol
?1
)
-1
1 2$$ )
> 9 01% -
2. ,erapa !olume 2 gram gas 34 yang diukur pada suhu dan tekanan di
mana 1 gram gas C/
:
!olumenya 1#% liter <&r 3 9 1:# 4 9 10# C 9 12# / 9
1=(
Cara B <dengan !olum molar=
Jumlah mol dari 1 gram gas C/
:
9 9 mol
>olume dari mol C/
:
9 1#% liter
1$
B gas
V
n
A gas
V
n
atau
2
V
2
n
1
V
1
n
atau
2
n
1
n
2
V
1
V
= = =
*oto+ Soal
'aka !olume dari 1 mol C/
:
9 9 2: liter
,erdasarkan hipotesis &!ogadro# pada suhu dan tekanan yang sama# 1 mol
gas C/
:
yang !olumenya 2: liter berlaku juga untuk !olume 1 mol gas
34# yaitu sebesar 2: liter.
Jumlah mol dari 2 gram gas 34 9 9 $#1 mol
>olume 34 9 $#1 mol 1 2: liter;mol
92#: liter
Cara BB <dengan /ipotesis &!ogadro=
"ari *ara pertama sudah dihitung bahwa#
3 34 9 $#1 mol n C/
:
9 mol
> 34 9 ( liter > C/
:
9 1#% liter
'enurut hipotesis &!ogadro#
> 34 : > C/
:
9 n 34 : n C/
:
> 34 9 1 > C/
:
9 1 1#% liter 9 2#: liter
11
*. 5-M-S EMP454S, 5-M-S MOLEK-L 6 A45 K54STAL
1. Humus Kmpiris
Humus empiris <HK= atau rumus perbandingan adalah rumus kimia
yang menyatakan jenis dan perbandingan paling sederhana dari atom-atom
yang terdapat dalam suatu senyawa.
Contoh:
12
7Sis"a 0apat meet2ka r2m2s empiris
s2at2 se!a"a.
7Sis"a 0apat meet2ka r2m2s molek2l
s2at2 se!a"a.
7Sis"a 0apat meet2ka r2m2s se!a"a
+i0rat.
Humus molekul glukosa adalah C
0
/
12
4
0
# rumus empirisnya adalah C/
2
4#
berarti perbandingan mol atom C : / : 4 adalah 1 : 2 : 1.
/al yang harus diupayakan pada penetapan rumus empiris
suatu senyawa adalah menentukan jumlah mol atau perbandingan mol unsur
penyusun senyawa tersebut. ,erikut merupakan tabel rumus molekul dan
rumus empiris beberapa senyawa.
3ama enyawa Humus 'olekul Humus Kmpiris
&ir /
2
4 /
2
4
Alukosa C
0
/
12
4
0
C
2
/
2
4
,enzena C
0
/
0
C/
Ktilena C
2
/
:
C/
2
&setilena C
2
/
2
C/
2. Humus 'olekul
Humus senyawa merupakan rumus kimia yang menunjukkan jumlah
atom unsur-unsur yang membentuk ikatan dalam satu senyawa dam memiliki
massa molekul relatiC yang pasti. Humus senyawa bukan lagi dalam bentuk
perbandingan# tetapi sudah merupakan bentuk Cinal dari suatu rumus pada
suatu senyawa. 'assa molekul relatiC juga sudah diketahui karena jumlah
atomnya sudah pasti.
Humus molekul <H'= zat menyatakan jenis dan jumlah atom
dalam tiap molekul zat itu. /anya zat yang partikelnya berupa molekul
yang mempunyai rumus molekul.
Contoh: /
2
4 <air=# C
0
/
12
4
0
<glukosa=# C
0
/
0
<benzene=# dan lain sebagainya.
Penentuan rumus molekul <H'= :
12
H' 9 <HK=n L 'r H' 9 <L 'r HK=n
2. &ir )ristal; enyawa /idrat
)ristal merupakan zat padat yang bentuknya teratur. )ristal umumya
terbentukn dari suatu zat *air atau larutan yang mengalami proses pemadatan
atau penguapan se*ara perlahan-lahan. )ristal pada garam tembaga <BB= sulCat
mempunyai air kristal sebanyak % molekul dalam setiap satuan rumus
kimianya# sehingga ditulis Cu4
:
.%/
2
4.
Penentuan jumlah kristal air dapat dilakukan dengan berbagai *ara#
misalnya dengan memanaskan kristal sehingga air kristalnya terlepas.
)emudian dari massa kristal sebelum dan sesudah pemanasan dapat
ditentukan massa air kristalnya. Jika senyawa tersebut ternyata tidak stabil
pada pemanasan# maka penentuan jumlah air kristal dilakukan dengan
menganalisis melalui reaksi kimia.
*oto+ 8
Cu4
:
. % /
2
4 < terusi =
Ca4
:
. 2 /
2
4 < gipsum =
'g4
:
. 5 /
2
4 < garam Bnggris =
3a
2
C4
2
. 1$ /
2
4 < soda hablur=
1. "alam 2 gram suatu senyawa karbon terdapat 1#2 gram karbon <C=#
$#2 hidrogen </=# dan sisanya oksigen <4=. Tentukanlah rumus
empiris senyawa tersebut jika diketahui &r /91# C912# dan 4910@
Jawab:
"iketahui:
'assa senyawa9 2 gram
'assa karbon <C=9 1#2 gram
'assa hydrogen </=9 $#2 gram
&r /91# C912# dan 4910
1:
*oto+ Soal
"itanyakan:
Humus empiris senyawa(
Peren*anaan
'enentukan massa oksigen 9 massa senyawa ? <massa C J massa /=
'enentukan jumlah mol masing-masing atom
'embandingkan mol masing-masing atom
'enentukan rumus empiris
Perhitungan
'assa 4 9 2 g ? <1#2 g J $#2 g= 9 1#0 gram
'ol C 9 9 $#1 mol
'ol / 9 9 $#2 mol
'ol 4 9 9 $#1 mol
Perbandingan mol C : / : 4 9 $#1 mol : $#2 mol : $#1 mol 9 1 : 2 : 1
Humus empiris senyawa9 C/
2
4
2. uatu senyawa mempunyai rumus empiris C/
2
4 dan massa molekul
relatiC 0$. Jika diketahui massa atom relatiC /91# C912# dan 4910#
maka rumus molekul senyawa itu adalahM
Jawab:
&nalisis
"iketahui:
Humus empiris : C/
2
4
'r senyawa : 0$ g;mol
&r /9 1# C912# 4910
"itanyakan:
Humus molekul(
1%
Peren*anaan
'enentukan rumus molekul dari rumus empiris yang telah diketahui
H' 9 <HK=n L 'r H' 9 <L 'r HK=n
'enentukan rumus 'r rumus empiris
'r C/
2
4 9 <&r C= J <&r / 1 2= J <&r 4=
Perhitungan
'r C/
2
4 9 <&r C 1 1= J <&r / 1 2= J <&r 4 1 1=
9 <12 1 1= J <1 1 2= J <10 1 1=
9 12 J 2 J 10
9 2$ g;mol
L 'r H' 9 <L 'r HK=n
0$ g;mol 9 < 2$ g;mol= n
n 9
n 9 2
H' 9 <HK=n H' 9 <C/
2
4=
2
H' 9 C
2
/
:
4
2
9. KA9A5 :AT
,erapa persen massa hidrogen dalam air( Humus empiris senyawa dapat
dintetukan jika kadar unsure-unsurnya diketahui. /al sebaliknya tentu dapat
berlaku# yaitu bahwa kadar unsur-unsur dapat ditentukan berdasarkan rumus
empiris atau rumus kimia senyawa. eperti telah diketahui# rumus kimia senyawa
10
Tujuan Pembelajaran:
iswa dapat menentukan kadar suatu zat
dalam senyawa
menyatakan perbandingan mol atom unsur penyususnnya. "ari perbandingan
atom dapat ditentukan perbandingan massa dan kadar unsur-unsur dalam
senyawa.
)adar menunjukkan komposisi bagian dalam satu komponen kompleks.
1. Persentase <N=
)adar unsure dalam senyawa dapat di nyatakan dengan persentase mol
unsur dalam senyawa tersebut. Persentase unsure dalam senyawa dapat
dirumuskan:
N & dalam &m,n 9 1 1$$N
N , dalam &m,n 9 1 1$$N
"engan *ara yang sama# persamaan di atas dapat digunakan untuk
men*ari massa senyawa <unsure= dala sejumlah massa zat sebagai berikut:
'assa & dalam p gram &m,n 9 1 p gram
2. 'olaritas
istem konsentrasi ini didasarkan !olume larutan dank arena itu
nyaman untuk digunakan dalam prosedur laboratorium dimana !olume larutan
merupakan kuantitas yang diukur. 'olaritas merupakan banyaknya mol zat
terlarut per liter larutan.
' 9 1
2. 'olalitas
'olalitas meruakan banyaknya mol zat terlarut dalam pelarut.
m 9 1
15
:. Part Per 'illion <,agian per juta=
ystem ini memberikan beberapa bagian satu komponen itu dalam 1 juta
bagian *ampuran.
Ppm 9 1
%. Oraksi 'ol
Oraksi mol adalah suatu besaran konsentrasi yang menyatakan
perbandingan jumlah mol zat terlarut terhadap jumlah mol larutan. Oraksi mol
tidak memiliki satuan dan sinyatakan dengan simbol P. Craksi mol terdiri dari
Craksi mol zat terlarut dan Craksi mol pelarut yang dinyatakan dengan rumus
berikut:
P&9
P&9
ehingga diperoleh hubungan Craksi mol zat terlarut dan Craksi mol
pelarut. /ubungan tersebut dinyatakan dengan rumus:
P&JP,91
)on!ersi atuan )onsentrasi -arutan:
"ari persen <N= berat :
1 1$ 1
'r&
N
&
= M
p
&
N
1$$$
1
'r
N
A
m =
16
,
,
&
&
&
'r
N
'r
N
'r
N
+
=
A
X
A
"ari 'olar <'= :
1 1$
'r 1 '
N
&
=
A
1$$$
'r 1 '
-
'
&
= m
= 1 <1$$$ = 'r - <'r '
'r 1 '
& ,
,
+
=
A
X
"ari molal <m= :
N 1$$
1$$$ = 'r 1 <m
'r 1 m
N
&
&
x
A
+
=
1$$$
'r 1 m
1
1 m
&
+
=
M
,
'r
1$$$
m
m
+
=
A
X
"ari Oraksi mol zat terlarut <P&= :
N 1$$
= 'r 1 <P = 'r 1 <P
'r 1 P
N
, , & &
& &
x
A
+
=
= 'r 1 <P = 'r 1 <P
1 1$$$ 1 P
, , & &
&
+
=
M
= 'r 1 <P
1$$$ 1 P
, ,
&
= m
Catatan :
1D
& 9 zat terlarut
, 9 pelarut
9 massa jenis larutan
N, 9 1$$ - N&
P, 9 1 ? P&
ukrosa memiliki rumus molekul C
12
/
22
4
11
. )adar unsure-unsur penyusun
senyawa itu dapat ditentukan sebagai berikut.
1. Humus kimia senyawa: C
12
/
22
4
11
2. Perbandingan mol atom unsure C : / : 4 9 12 : 22 : 11
2. Perbandingan massa unsure
C : / : 4 9 <12 1 12= : <22 1 1= : <11 1 10= 9 1:: : 22 : 150
:. Jumlah perbandingan 9 1:: J 22 J 150 9 2:2 9 'r C
12
/
22
4
11
)adar C 9 1 1$$ N 9 :2#1 N
)adar / 9 1 1$$N 9 0#: N
)adar 4 9 1 1$$N 9 %1#% N
2$
*oto+ Soal
T-/AS PO5TO;OL4O
M4N//- PE5TAMA
40ikator -raia T2&as
'engon!ersi
kan jumlah
mol dengan
jumlah
partikel
1. etiap siswa diperkenankan untuk membuat soal beserta jawabannya
mengenai bagaimana *ara mengon!ersikan jumlah mol dengan jumlah
partikel pada suatu senyawa yang mengandung salah satu unsure pada
istem Periodik .nsur sebanyak 2 soal.
Contoh:
aya mengambil unsure Cu <Tembaga= untuk mengerjakan tugas.
oal:
,erapa mol tembaga yang terdapat dalam 2#$1 1 1$
2:
partikel tembaga(
Jawab:
Jumlah partikel Tembaga 9 2#$1 1 1$
2:
partikel
1 mol Cu mengandung 9 0#$2 1 1$
22
partikel
21
M4N//- PE5TAMA
40ikator -raia T2&as
Jadi banyaknya mol Cu 9 1
9 % mol
'engon!ersi
kan jumlah
mol dengan
massa zat
2. etiap siswa diperkenankan untuk membuat soal beserta jawabannya
mengenai bagaimana *ara mengon!ersikan jumlah mol dengan massa zat
pada suatu senyawa yang mengandung salah satu unsure pada istem
Periodik .nsur sebanyak 2 soal.
Contoh:
aya mengambil ,elerang <= untuk mengerjakan tugas.
oal:
,erapa mol unsure ,elerang <= yang bermassa 10 gram jika diketahui
massa molar 9 22gram;mol(
Jawab:
'enggunakan rumus:
' 9 n 1 'm
Jadi banyaknya mol ,elerang adalah n 9 9 9 $#% mol
'engon!ersi
kan jumlah
mol dengan
!olume zat
2. etiap siswa diperkenankan untuk membuat soal beserta jawabannya
mengenai bagaimana *ara mengon!ersikan jumlah mol dengan massa zat
pada suatu senyawa yang mengandung salah satu unsure pada istem
Periodik .nsur sebanyak 2 soal.
aya mengambil unsure C untuk menjadi salah satu unsure dalam senyawa
yang akan saya buat soalnya.
oal:
,erapakah massa 1$ liter C/
:
<'r 9 10= diukur pada $C dan tekanan 1 atm(
Jawab:
Jumlah mol C/
:
9 9 $#::5 mol
22
M4N//- PE5TAMA
40ikator -raia T2&as
'assa gas C/
:
9 $#::0 mol 1 10 gram;mol
9 5#120 gram
Jadi massa gas methan sebanyak 5#120 gram
'embuktika
n berlakunya
hipotesis
&!ogadro
Petunjuk pengerjaan tugas:
Jawablah pertanyaan-pertanyaan di bawah ini dengan membuat skema
pengerjaan sebelum menjawabnya.
1. ,erapakah !olum dari 2 gram gas nitrogen monoksida <34= yang diukur
pada suhu dan tekanan yang sama dengan 1 gram gas metana <C/
:
= dengan
!olum 1#% liter( <&r 391:# 4910# /91=
2. Tentukan !olume 22 gram gas C4
2
# jika pada suhu dan tekanan yang
sama# 6 gram gas 4
2
!olumenya 9 1$ liter. <'r C42 9 ::# 'r 42 9 6$=
2. &pabila 0#$2.1$
22
molekul gas 34 mempunyai !olum 2liter pada suhu
dan tekana tertentu# maka pada keadaan yang sama !olum dari 2#$111$
22
molekul gas 3
2
adalahM.( <&r 391:# 4910=
'enemukan
hubungan
antara
tekanan#
suhu# dan
!olume dari
suatu gas
pada keadaan
tertentu pada
hukum Aas
Bdeal
Jawablah soal-soal beriku ini@
1. eorang ibu rumah tangga baru saja membeli tabung gas -PA yang
berisi gas C/
:
ber!olum 2$ liter. &gar massa gas menjadi 12 kg pada
suhu 25C# berapakah tekanan udara yang dibutuhkan oleh ibu tersebut
jika 'r C/
:
910 g;mol dan C/
:
dianggap sebagai gas ideal(
2. uatu tabung dengan !olume tertentu berisis 12 kg gas 4
2
. Tabung tersebut
dikosongkan# kemudian pada suhu dan tekanan yang smaa isinya diganti
dengan gas C/
:
. ,erapa massa gas C/
:
yang ada di dalam tabung tersebut(
<&r C 9 12# 4 9 10=
,uatlah kema Pembelajaran Bnterkon!ersi 'ol-Aram->olume dan jabarkan
setiap koneksinya menurut bahasa kalian sendiri@
M4N//- KE9-A
40ikator -raia T2&as
'enetukan
rumus
empiris suatu
senyawa
Petunjuk pengerjaan tugas@
1. 'asuklah ke dalam laboratorium kimia bersama kelompokmu.
2. ,ukalah rak larutan.
2. Pilih dan *atat % larutan se*ara a*ak.
:. Carilah inCormasi dari berbagai sumber mengenai larutan tersebut.
%. &nalisislah se*ara indi!idual# larutan tersebut termasuk rumus empiris atau
rumus molekul# beri alasanmu@
'enentukan
rumus
molekul
suatu
senyawa dan
Petunjuk pengerjaan tugas@
1. 'asuklah ke dalam laboratorium kimia bersama kelompokmu.
2. ,ukalah rak bahan.
2. Pilih dan *atat % bahan se*ara a*ak.
:. Carilah inCormasi dari berbagai sumber mengenai bahan tersebut.
22
M4N//- PE5TAMA
40ikator -raia T2&as
'enentukan
rumus
senyawa
hidrat
%. &nalisislah se*ara indi!idual# bahan tersebut termasuk rumus empiris atau
rumus molekul# beri alasanmu@
'enghitung
kadar suatu
zat
Petunjuk Pengerjaan Tugas@
1. &mbil kemasan minuman atau makanan yang tidak terpakai.
2. Potong pada bagian kandungan dalam minuman atau makanan tersebut.
2. Temple pada kertas tugas &nda.
:. Cari inCormasi mengenai setiap kandungan tersebut# singkat saja satu
kandungan 1 paragraC inCormasi.
%. )emudian analisis dan hitung kadar <N= setiap kandungan tersebut.
5AN/K-MAN
1. atu mol adalah sejumlah partikel yang terkandung di dalam suatu zat yang
jumlahnya sama dengan banyaknya atom yang terdapat di dalam 12#$$ gram
C-12
2. Tetapan &!ogadro adalah bilangan bilangan yang digunakan untuk
menyatakan jumlah partikel 1 mol zat# yaitu 0#$2 1 1$ 22 partikel <atom# ion#
atau molekul=# dan dinyatakan dengan lambing 3.
2. 'assa molar adalah massa zat yaitu yang sama dengan massa atom atau massa
rumus zat tersebut dinyatakan dalam gram.
2:
:. >olume molar gas adalah !olume 1 mol gas pada suhu dan tekanan tertentu.
jika pengukuran dilakukan pada suhu $C dan tekanan 1 atm# !olume molar
gas disebut sebagai !olume molar standar.
%. /ipotesis &!ogadro menyatakan bahwa pada suhu dan tekanan yan sama#
sejumlah !olume yang sama suatu gas <sembarang gas= mengandung jumlah
molekul yang sama.
0. Persamaan gas ideal menerangkan hubungan empat !ariable <suhu# tekanan#
!olume# dan jumlah mol gas= terhadap perilaku gas ideal# yaitu gas yang
molekul-molekulnya dianggap tidak saling tarik-menarik# tidak saling tolak
menolak# dan !olumenya dapat diabaikan terhadap !olume wadahnya.
5. Pada gas ideal berlaku
6. Humus empiris senyawa dapat ditentukan# jika kadar unsure-unsurnya
diketahui.
D. Humus molekul dapat ditentukan dari rumus empiris# jika massa molekul
relati!e <'r=senyawa diketahui.
1$. )adar unsur dalam senyawa data ditentukan dari rumus kimianya.
5E;LEKS4
&pakah &nda sudah bisa menguasai pokok bahasan ini degan baik( .ntuk
mengukur tingkat keberhasilan belajar &nda# berilah tanda checklist <= pada tabel
di bawah ini@
3o Bndikator
Tingkat Penguasaan
1 2 2 :
1 'enghitung jumlah mol satu zat
2 'engon!ersikan jumlah mol dengan
jumlah partikel
2 'enentukan massa suatu zat
2%
>
1
:>
2
9 n
1
:n
2
P>9nHT
: 'enghitung !olume suatu zat
% 'embuktikan berlakunya hipotesis
&!ogadro
0 'enemukan hubungan antara teanan# suhu#
dan !olume dari suatu gas pada keadaan
tertentu pada /ukum Aas Bdeal
5 'enentukan rumus empiris suatu senyawa
6 'enentukan rumus molekul suatu senyawa
D 'nentukan rumus senyawa hidrat;air kristal
1$ 'enentukan kadar persen <N= suatu zat
dalam senyawa
11 'enentukan 'olaritas suatu larutan
12 'enentukan 'olalitas suatu larutan
12 'enentukan Oraksi mol suatu senyawa
1: 'enentukan kadar ppm suatu larutan
)eterangan:
1 9 angat )urang 29 ,aik
29 )urang :9 angat ,aik
-LAN/AN ,A54AN
1. "alam satu mol air terdapat 0#$22 1 1$
22
molekul /
2
4. Jika dalam 1 m- air
sumur terdapat 2 mol air# berapakah jumlah molekul air sumur tersebut jika
tertampung sebanyak 1 gayung <%$$m-=(
a. 0#$22 1 1$
20
b. 12#$:: 1 1$
20
*. 0#$22 1 1$
2:
d. 12#$:: 1 1$
22
e. 0#$22 1 1$
22
2. Aas /2 adalah suatu gas yang banyak terdapat di salam. 15 gram di alam
adalah jumlah yang *ukup banyak. Peneliti ingin mengetahui !olume gas
tersebut jika ia mengukurnya pada keadaan standar <TP=. ,erapakah !olum
yang didapat peneliti ersebut( <&r / 9 1# 9 22=
a. 22#: -
20
b. 11#2 -
*. 1#12 -
d. 2#2: -
e. $#22: -
2. "itemukan suatu senyawa terdiri dari 0$N )arbon# %N /idrogen# dan isanya
3itrogen. Jika 'r seyawa itu 9 6$ g;mol. ,agaimanakah rumus empiris
senyawa tersebut( <&r C 9 12# / 9 1# 3 9 1:=
a. C/3
b. C/3
2
*. C
2
/3
2
d. C/
2
3
2
e. C
2
/
2
3
:. ,erapakah persen besi yang terdapat dalam Oe242 jika diketahui &r Oe 9 %0
dan 4 9 10(
a. 11#2 N
b. 1$ N
*. %0 N
d. 5$ N
e. 5% N
%. uatu senyawa mempunyai rumus empiris C/
2
4 dan massa relati!e 0$. Jika
diketahui massa atom relati!e / 9 1# C9 12# 4910# maka rumus molekul
senyawa itu adalahM
a. /C/4
b. C/
2
C44/
*. C/
2
C/
2
4
d. C
2
/
0
4
2
e. C/
2
C/
2
4/
K-N*4 <A=A'AN
1. &
25
2. ,
2. K
:. "
%. ,
9A;TA5 P-STAKA
,rady# K. James. )imia .ni!ersias &sas dan truktur Jilid 1 Kdisi ke %. Jakarta:
Krlangga.
'alone# J. -eo and "olter# 4. Theodore. ,asi* Con*ept oC Chemistry 6
th
. 3er
Qork: John Riley and ons.
'i*hael# Purba. 2$$5. )imia untuk '& )elas P emester 1. Jakarta: Krlangga.
Peraturan 'enteri Hepublik Bndonesia 3omor %: Tahun 2$12 tentang tandar
)ompetensi -ulusan untuk atuan Pendidikan "asar dan 'enengah.
Peraturan 'enteri Hepublik Bndonesia 3omor 0: Tahun 2$12 tetang tandar Bsi
untuk atuan Pendidikan 'enengah.
tirrup# 'artin. 1DDD. Chemistry. -ondon: /einemann Kdu*ational Publishers.
26
yukri# . 1DDD. )imia "asar. ,andung: BT,.
.nggul# udarmo. 2$12. )imia untuk '&;'& )elas P. Jakarta: Krlangga.
2D
Anda mungkin juga menyukai
- RPP Hukum-Hukum Dasar Kimia PPLDokumen13 halamanRPP Hukum-Hukum Dasar Kimia PPLLahmi Ladzdzatul HikmahBelum ada peringkat
- Percobaan KimiaDokumen45 halamanPercobaan KimiaLhjhBelum ada peringkat
- PARTISIPASI MAHASISWADokumen20 halamanPARTISIPASI MAHASISWAAmalina Devi Kasturi50% (2)
- Analisis Hasil Uji Coba AngketDokumen14 halamanAnalisis Hasil Uji Coba AngketAmalina Devi KasturiBelum ada peringkat
- Tabel Indikator Berpikir KritisDokumen1 halamanTabel Indikator Berpikir KritisAmalina Devi KasturiBelum ada peringkat
- HUKUM KIMIA DASARDokumen6 halamanHUKUM KIMIA DASARsepti kristinaBelum ada peringkat
- GAYA ANTARMOLEKULDokumen9 halamanGAYA ANTARMOLEKULIsmatul IzzatiBelum ada peringkat
- STOIKIOMETRIDokumen7 halamanSTOIKIOMETRIElma ShofaBelum ada peringkat
- Kisi-Kisi Dan Soal Hukum Dasar Kimia (Dalton-Gay Lussac-Avogadro)Dokumen12 halamanKisi-Kisi Dan Soal Hukum Dasar Kimia (Dalton-Gay Lussac-Avogadro)dinar SMPITAF100% (2)
- Instrumen Soal HOTSDokumen4 halamanInstrumen Soal HOTSabdul harisBelum ada peringkat
- LKPD Hukum KimiaDokumen22 halamanLKPD Hukum KimiaPutriBelum ada peringkat
- RPP Redoks dan ElektrokimiaDokumen22 halamanRPP Redoks dan ElektrokimiaagussujadmikoBelum ada peringkat
- Ikatan KimiaDokumen8 halamanIkatan KimiaYahya Bachrun100% (1)
- KIMIA-X-Ganjil-SMA BonaDokumen24 halamanKIMIA-X-Ganjil-SMA BonaatmisuindartiBelum ada peringkat
- Peta Konsep Mol Dan Kadar ZatDokumen1 halamanPeta Konsep Mol Dan Kadar ZatLaila Fitriah Before Reborn100% (1)
- 6 Konsep MolDokumen47 halaman6 Konsep Molannisa rahmah100% (1)
- LKPD Hukum Dasar KimiaDokumen6 halamanLKPD Hukum Dasar KimiaDhiya Nabilah JanwarBelum ada peringkat
- E-LKPD STOIKIOMETRI - Rista AjengDokumen35 halamanE-LKPD STOIKIOMETRI - Rista Ajengummu AhmadBelum ada peringkat
- CP, TP Dan ATP KIMIADokumen4 halamanCP, TP Dan ATP KIMIAFajar Rohman Riswara100% (1)
- Kimia Hukum DasarDokumen34 halamanKimia Hukum DasarBurma Michael SipayungBelum ada peringkat
- LKPD Ikatan KimiaDokumen6 halamanLKPD Ikatan Kimianada maghfiraBelum ada peringkat
- Perhitungan Kimia (Pereaksi Pembatas)Dokumen32 halamanPerhitungan Kimia (Pereaksi Pembatas)winda arisusanti100% (1)
- RPP-modul Ajar TaRL-Ar Dan MR KimiaDokumen11 halamanRPP-modul Ajar TaRL-Ar Dan MR Kimiaa e100% (1)
- RPP Hukum Dasar KimiaDokumen33 halamanRPP Hukum Dasar KimiaHajrah HajrahBelum ada peringkat
- Silabus Struktur AtomDokumen2 halamanSilabus Struktur AtomAuliya0% (1)
- Inovasi Pembelajaran Kimia Berbasis ETNOSAINSDokumen202 halamanInovasi Pembelajaran Kimia Berbasis ETNOSAINSsiti mahmudahBelum ada peringkat
- Soal Evaluasi Elektrolit dan Non ElektrolitDokumen4 halamanSoal Evaluasi Elektrolit dan Non ElektrolitSMA ABBSBelum ada peringkat
- Laju ReaksiDokumen11 halamanLaju ReaksiAbah YatemanBelum ada peringkat
- RPP DISCOVERY LEARNING Konsep Mol Dan Hukum Dasar KimiaDokumen7 halamanRPP DISCOVERY LEARNING Konsep Mol Dan Hukum Dasar KimiaTheresia Putri100% (1)
- Soal Benar Salah 20 SoalDokumen4 halamanSoal Benar Salah 20 SoalNovianti HABelum ada peringkat
- RPP Senyawa HidratDokumen20 halamanRPP Senyawa HidratFitri Ameita SaryBelum ada peringkat
- Pemetaan Standar Isi KimiaDokumen32 halamanPemetaan Standar Isi Kimiaarchemist100% (1)
- Titik Didih HidrokarbonDokumen2 halamanTitik Didih HidrokarbonEra MelaniaBelum ada peringkat
- Hukum Dasar KimiaDokumen11 halamanHukum Dasar KimiaT P Siahaan100% (2)
- Modul (Bahan Ajar) Ikatan Kimia.1 - Natalia, S.PDDokumen40 halamanModul (Bahan Ajar) Ikatan Kimia.1 - Natalia, S.PDindah fajar watiBelum ada peringkat
- Analisis Soal Pilihan Ganda Dan Esay Ikatan KimiaDokumen7 halamanAnalisis Soal Pilihan Ganda Dan Esay Ikatan KimiaAndrian PeaceBelum ada peringkat
- LKPD Konsep MolDokumen9 halamanLKPD Konsep MolHerlina Lina100% (1)
- HIDROKARBONDokumen30 halamanHIDROKARBONfatmadhezarBelum ada peringkat
- Analisis Konsep Ikatan Kimia Kelompok Mas MuiDokumen32 halamanAnalisis Konsep Ikatan Kimia Kelompok Mas Muiastri maulidaBelum ada peringkat
- V RPP KD 3.3 REDOKS+ELEKTROKIMIADokumen20 halamanV RPP KD 3.3 REDOKS+ELEKTROKIMIAarina manasikanaBelum ada peringkat
- RPP 3.10 Kimia X RUMUS MOLEKUL DAN EMPIRISDokumen13 halamanRPP 3.10 Kimia X RUMUS MOLEKUL DAN EMPIRISSyarifah RBelum ada peringkat
- Silabus. XI. 3.5 TermokimiaDokumen6 halamanSilabus. XI. 3.5 TermokimiaNaniek RosyidahBelum ada peringkat
- RPP Kimia X KD 3.7 4.7Dokumen7 halamanRPP Kimia X KD 3.7 4.7agustin kurniati0% (1)
- 5.representasi KimiaDokumen15 halaman5.representasi KimianurlaelawasthiBelum ada peringkat
- Soal Post Tes Hakikat Ilmu KimiaDokumen2 halamanSoal Post Tes Hakikat Ilmu Kimiaaffan100% (2)
- Soal PengayaanDokumen2 halamanSoal PengayaanKharis MaulanaBelum ada peringkat
- Makalah Karakteristik Pembelajaran KimiaDokumen18 halamanMakalah Karakteristik Pembelajaran KimiaEka Putra Ramandha100% (1)
- Modul Hukum Dasar KimiaDokumen29 halamanModul Hukum Dasar KimiaNisa aprlna100% (2)
- RPP Ikatan KimiaDokumen9 halamanRPP Ikatan KimiamentarizkyawatiBelum ada peringkat
- LKPD 1 Perkembangan Model AtomDokumen5 halamanLKPD 1 Perkembangan Model AtomPriyatiBelum ada peringkat
- STRUKTUR ATOMDokumen16 halamanSTRUKTUR ATOMTri WahyuniBelum ada peringkat
- Multiple RepresentativeDokumen10 halamanMultiple RepresentativeDyah YuniBelum ada peringkat
- OPTIMIZEDDokumen6 halamanOPTIMIZEDDwivelia AftikaBelum ada peringkat
- RPP Teori TumbukanDokumen19 halamanRPP Teori TumbukanNovi Chairani MasdumBelum ada peringkat
- BINGKIMDokumen50 halamanBINGKIMPUPE PILIANI100% (1)
- Latihan Soal Hukum - Hukum Dasar KimiaDokumen4 halamanLatihan Soal Hukum - Hukum Dasar KimiaNadya RamadhaniBelum ada peringkat
- Panduan Praktikum KD I 2020 Edisi Daring UGMDokumen52 halamanPanduan Praktikum KD I 2020 Edisi Daring UGMRICKY FASHA SETIAWANBelum ada peringkat
- Analisis Konsep Laju ReaksiDokumen6 halamanAnalisis Konsep Laju ReaksiDudi Fathul JawadBelum ada peringkat
- Kul 3a Persamaan Keadaan Gas (Undip)Dokumen23 halamanKul 3a Persamaan Keadaan Gas (Undip)rima kurniasari100% (2)
- RPP 3.11 StoikiometriDokumen55 halamanRPP 3.11 Stoikiometrisetia pakpahan100% (1)
- LKS Orde Reaksi Dan Persamaan LajuDokumen5 halamanLKS Orde Reaksi Dan Persamaan LajuAriyana IntanBelum ada peringkat
- KIMIA XIDokumen2 halamanKIMIA XIDewi IkmahBelum ada peringkat
- STOIKIOMETRI GASDokumen28 halamanSTOIKIOMETRI GASSMA ABBSBelum ada peringkat
- Topik2 - Mulai Dari Diri - FpiDokumen3 halamanTopik2 - Mulai Dari Diri - FpiKenzibi KidsBelum ada peringkat
- Topik1 - Aksi Nyata - FpiDokumen2 halamanTopik1 - Aksi Nyata - FpiAmalina Devi KasturiBelum ada peringkat
- KONSEP KIMIA DASARDokumen43 halamanKONSEP KIMIA DASARPanji Nur Suhut100% (1)
- 85c132b292889cbef1913e19c1aaaa15Dokumen12 halaman85c132b292889cbef1913e19c1aaaa15Amalina Devi KasturiBelum ada peringkat
- Model Pembelajaran BerbasisDokumen241 halamanModel Pembelajaran BerbasisAmalina Devi KasturiBelum ada peringkat
- 101127-Diyah Rauhillah Hasni-FitkDokumen177 halaman101127-Diyah Rauhillah Hasni-FitkAmalina Devi KasturiBelum ada peringkat
- Penilaian Dan Model Rapor SMP - Gabungan-FinalDokumen162 halamanPenilaian Dan Model Rapor SMP - Gabungan-FinalJonyShinoBelum ada peringkat
- IPA8_BAB1Dokumen366 halamanIPA8_BAB1Amalina Devi KasturiBelum ada peringkat
- Bornok Asesmen Otentik Dan Asesmen Kelas I Sma 2012Dokumen30 halamanBornok Asesmen Otentik Dan Asesmen Kelas I Sma 2012Fajar FirdausiBelum ada peringkat
- Modul PembelajaranDokumen7 halamanModul PembelajaranAmalina Devi KasturiBelum ada peringkat
- Bab IiDokumen46 halamanBab IiAmalina Devi KasturiBelum ada peringkat
- pH INDIKATORDokumen20 halamanpH INDIKATORAmalina Devi KasturiBelum ada peringkat
- Buku Panduan LKMM Kurikulum Dikti 2011.batuDokumen11 halamanBuku Panduan LKMM Kurikulum Dikti 2011.batuHaposan SimatupangBelum ada peringkat
- RPP Koloid TM 1Dokumen13 halamanRPP Koloid TM 1Amalina Devi KasturiBelum ada peringkat
- RPP Kimia KTSPDokumen213 halamanRPP Kimia KTSPMuhammad AlamsyahBelum ada peringkat
- Program TahunanDokumen9 halamanProgram TahunanAmalina Devi KasturiBelum ada peringkat
- Reaksi Metatesis IonDokumen1 halamanReaksi Metatesis IonAmalina Devi KasturiBelum ada peringkat
- SEA URCHIN GUIDEDokumen8 halamanSEA URCHIN GUIDEAmalina Devi KasturiBelum ada peringkat
- Fungsi Rumput Gajah Sebagai Selulosa FermentasiDokumen2 halamanFungsi Rumput Gajah Sebagai Selulosa FermentasiAmalina Devi KasturiBelum ada peringkat