Kelarutan
Diunggah oleh
Selvia WidyawatiDeskripsi Asli:
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Kelarutan
Diunggah oleh
Selvia WidyawatiHak Cipta:
Format Tersedia
Kelarutan Zat ( Diagram Terner )
BAB I
PENDAHULUAN
1.1 Tujuan Percobaan
1. Menentukan kelarutan suatu zat dalam suatu zat pelarut,
2. Menggambarkan fase diagram tiga komponen,
3. Menerapkan dalam menentukan komposisi kadar minyak pengering dalam
zat
1.2 Dasar Teori
Kelarutan adalah jumlah zat terlarut yang dapat larut dalam pelarut yang
banyaknya tertentu, untuk menghasilkan suatu larutan jenuh. Zat cair yang
hanya sebagian larut dalam zat cair lainnya, dapt dinaikan kelarutannya dengan
menambahkan suatu zat cair yang berlainan dengan kedua zat cair yang lebih
dahulu dicampurkan. Bila zat cair yang ketiga ini hanya larut dalam salah satu
zat cair yang terdahulu, maka biasanya kelarutan dari kedua zat cair yang
terdahulu itu akan menjadi kecil. Tetapi bila zat cair yang ketiga itu larut dalam
kedua zat cair yang terdahulu, maka kelarutan dari kedua zat cair yang
terdahulu akan menjadi lebih besar. Gejala ini dapat terlihat pada sistem
kloroform – asam asetat – air. Bila asam asetat ditambahkan kedalam suatu
campuran heterogen dari kloroform dan air pada suhu tertentu, kelarutan dari
kloroform dalam air itu akan bertambah, sehingga pada suatu ketika akan
menjadi homogeny. Jumlah asam asetat yang di tambahkan untuk mencapai
titik homogeny tergantung dari komposisi campuran kloroform dan air.
1.2.1 Faktor – Faktor Penyebab Kelarutan
Umumnya yang membuat zat melarut adalah kesejenisan, yaitu senyawa
yang non-polar larut dalam pelarut yang non-polar, begitu juga sebaliknya,
senyawa yang polar hanya dapat larut dalam pelarut yang polar juga.
POLITEKNIK NEGERI SAMARINDA
JURUSAN TEKNIK KIMIA 1
Kelarutan Zat ( Diagram Terner )
Dalam hal ini kita bisa mengambil contoh heksana dan heptana yang
keduanya adalah senyawa non-polar. Kedua zat tersebut mempunyai kerapatan
masing – masing 0.650 gram/ml dan 0.684 gram/ml. Mulanya yang
mempunyai kerapatn jenis yang kecil akan mengapung, namun beberapa saat
molekul – molekul akan menyebar secara acak, apalagi bila temperature
dinaikkan, kecepatan difusi akan lebih tinggi. Sehingga selang beberapa waktu
akan diperoleh larutan homogeny yang seragam ( miscible).
1.2.2 Sistem Tiga Komponen
Sistem tiga komponen aturan fase menghasilkan v = 5 – P. bila terdapat
suatu fase, maka v = 4, oleh karenanya penggambaran secara geometrik yang
lengkap memerlukan ruang berdimensi empat. Bila tekanan tetap, ruang tiga
dimensi dapat digunakan. Bila suhu maupun tekanan tetap, maka v = 3 – P dan
sistem dapat digambarkan dalam ruang tiga dimensi : P = 1
v = 2 Bivarian, P = 2; v = 1 Univarian, P = 3 ; v = 0 Invariant.
Untuk fase tunggal bagi sistem tiga komponen, terdapat 4 derajat
kebebasan :
F=C–P+2
=3–1+2
= 4 (temperatur, tekanan, susunan 2 dan 3 komponen)
Untuk menggambarkan garfik demikian sangat sukar, karena itu sistem
tiga komponen biasanya diselidiki pada tekanan tetap dan temperatur tetap.
Dengan demikian dapat digambarkan diagram fase yang menyatakan
susunan dua komponen. Diagram ini digambarkan sebagai segitiga sama sisi.
Suatu sistem tiga komponen mempunyai dua perubahan komposisi yang
bebas, sebut saja X2 dan X3, jadi komposisi suatu sistem tiga komponen dapat
di alurkan dalam koordinat cartes dengan X2 pada salah satu sumbunya dan X3
pada sumbu yang lain dibatasi oleh garis X2 + X3 = 1
POLITEKNIK NEGERI SAMARINDA
JURUSAN TEKNIK KIMIA 2
Kelarutan Zat ( Diagram Terner )
Karena X itu tidak simetris terhadap ketiga komponen, biasanya komposisi di
alurkan ,pada suatu segitiga sama sisi dengan tiap – tiap sudutnya
menggambarkan suatu komponen murni. Bagi suatu segitiga sama sisi, jumlah
jarak dari seberang titik di dalam segitiga ketiga sisinya sama dengan tinggi
segitiga tersebut. Jarak antara setiap sudut ketengah – tengah sisi yang
berhadapan dibagi 100 bagian sesuai dengan komposisi dalam persen. Untuk
memperoleh suatu titik tertentu dengan komposisi dalam persen. Untuk
memperoleh suatu titik tertentu dengan mengukur jarak terdekat ketiga sisi
segitiga.
Sistem tiga komponen sebenarnya banyak kemungkinannya. Dalam bagian
ini akan di pelajari :
A. Sistem 3 komponen yang terdiri atas zat cair yang sebagian tercampur
B. Sistem 3 komponen yang terdiri atas 2 komponen padat dan 1
komponen cair
A. Sistem 3 zat cair bercampur sebagian di bagi menjadi :
Tipe I : Pembentukan sepasang zat cair bercampur sebagian,
Tipe II : Pembentukan 2 pasang zat cair bercampur sebagian,
Tipe III : Pembentukan 3 pasang zat cair bercampur sebagian.
B. Sistem 3 komponen yang terdiri atas 2 komponen padat dan 1 cairan.
Dalam bagian ini hanya diambil bila cairan sebagian komponen ketiga
berupa air, sebab hal ini mempunyai arti penting dalam kristalisasi. Tergantung
dari zat yang mengkristal, sistem ini dibagi menjadi :
Tipe I : Yang mengkristal komponen murni,
Tipe II : Pembentukan senyawa biner,
Tipe III : Pembentukan senyawa terner,
Tipe IV : Pembentukan larutan padat
Tipe V : Fase padat bercampur sebagian.
POLITEKNIK NEGERI SAMARINDA
JURUSAN TEKNIK KIMIA 3
Kelarutan Zat ( Diagram Terner )
BAB 2
METODOLOGI
2.1 Alat dan Bahan
2.1.1 Alat yang digunakan
10 buah erlenmeyer
Buret
Statif dan klem
Gelas kimia 100 ml
Corong
Pipet ukur 10 ml
Bulp
Botol aquadest
Piknometer
Neraca Digital
2.1.2 Bahan yang digunakan
Asam asetat glasial
Kloroform
Aquadest
2.2 Prosedur Percobaan
2.2.1 Pencampuran 3 jenis larutan
1. Membuat campuran antara aquadest dan asam asetat glasial dengan
komposisi yang di variasikan,
2. Menambahkan masing – masing campuran dengan CHCl3 melalui buret
hingga terbentuk 2 lapisan,
POLITEKNIK NEGERI SAMARINDA
JURUSAN TEKNIK KIMIA 4
Kelarutan Zat ( Diagram Terner )
3. Mencatat volume CHCl3 yang terpakai dan di hitung masing – masing
komposisi zat dalam setiap campuran kemudian di buat diagram
ternernya.
2.2.2 Berat jenis larutan.
1. Menimbang pikno kosong dengan menggunakan neraca digital dan
mencatat hasil penimbangan,
2. Mengisi pikno tersebut dengan zat yang ingin di ketahui berat jenisnya,
3. Menimbang kembali pikno yang telah berisi zat tertentu lalu mencatat
hasil penimbangan,
4. Menghitung berat jenis zat dengan menggunakan data yang telah
diperoleh.
POLITEKNIK NEGERI SAMARINDA
JURUSAN TEKNIK KIMIA 5
Kelarutan Zat ( Diagram Terner )
BAB III
DATA PENGAMATAN
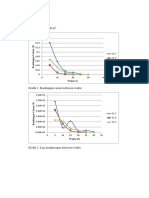
3.1 Volume CHCl3 yang diperlukan
Table 3.1 data volume CHCl3 yang di perlukan
Volume CH3COOH
Volume H2O (ml) Volume CHCl3 (ml)
(ml)
10 1 2.2
9 2 2.3
8 3 2.6
7 4 2.7
6 5 3.1
5 6 3.8
4 7 4.3
3 8 5.2
2 9 6.1
1 10 6.8
3.2 Hasil perhitungan massa dan berat jenis
Tabel 3.2 data massa sampel yang di gunakan
Massa
Massa H2O Massa CHCl3
Percobaan ke - CH3COOH
(H2O . VH2O) ( . V)
( . V)
1. 9.852 1.0408 3.2032
2. 8.8668 2.0816 3.3488
3 7.8816 3.1224 3..7856
4 6.8964 4.1632 3.9312
5 5.9112 5.204 4.5136
6 4.926 6.2448 5.5328
POLITEKNIK NEGERI SAMARINDA
JURUSAN TEKNIK KIMIA 6
Kelarutan Zat ( Diagram Terner )
7 3.9408 7.2856 6.2608
8 2.9556 8.3264 7.5712
9 1.9704 9.3672 8.8816
10 0.9852 10.408 9.9008
Ket :
H2O = 0.9852 gr/ml massa pikno = 23.35 gram
CH3COOH = 1.0408 gr/ml massa pikno + H2O = 47.98 gram
CHCl3 = 1.456 gr/ml massa pikno + CH3COOH = 49.37 gram
Volume pikno = 25 ml massa pikno + CHCl3 = 59.75 gram
3.3 Hasil perhitungan komposisi masing – masing zat
Tabel 3.3 data persen massa masing – masing sampel yang digunakan
Percobaan % massa % massa % massa
Ke- H2O CH3OOH CHCl3
1. 69.89% 7.38% 22.73%
2. 62.01% 14.56% 23.43%
3. 53.29% 21.11% 25.60%
4. 46% 27.78% 26.22%
5. 37.82% 33.3% 28.88%
6. 29.49% 37.39% 33.12%
7. 22.54% 41.66% 35.80%
8. 15.68% 44.16% 40.16%
9. 9.75% 46.33% 43.92%
10. 4.63% 48.88% 46.69%
BAB IV
PEMBAHASAN
POLITEKNIK NEGERI SAMARINDA
JURUSAN TEKNIK KIMIA 7
Kelarutan Zat ( Diagram Terner )
Praktikum ini bertujuan untuk menentukan kelarutan zat dalam suatu
zat pelarut, menggambarkan fase diagram tiga komponen dan menerapkannya dalam
menetukan komposisi kadar minyak pengeringan dalam zat. Sampel yang digunakan
yaitu CHCl3, CH3COOH, dan H2O.
Langkah pertama yaitu menetukan berat jenis masing – masing sampel
dengan menggunakan piknometer 25 ml. Berat jenis yang diperoleh dari hasil
pengukuran berbeda dengan berat jenis yang ada pada labelbotol penyimpanan
sampel. Dimana pada label botol penyimpanan tertulis H2O yaitu 1 gram/ml,
CH3COOH yaitu 1.0419 gram/ml, dan CHCl3 yaitu 1.48 gram/ml, sedangkan yang
diperoleh saat praktikum H2O = 0.9852 gram/ml, CH3COOH = 1.0408 gram/ml
dan CHCl3 = 1.456 gram/ml. Ini mungkin dikarenakan kondisi alat yang digunakan
kurang bersih karena pada penentuan berat jenis, jika alat yang digunakan kurang
bersih maka akan mempengaruhi hasil perhitungan.
Langkah selanjutnya yaitu mencampurkan dua komponen zat yaitu air
dan CH3COOH dengan volume yang divariasikan dari 1 – 10 ml. air dengan
CH3COOH akan bercampur menjadi larutan yang homogen karena air bersifat polar
dan CH3COOH bersifat semipolar. Zat yang memiliki sifat sama atau mirip akan
saling melarutkan ( like dissolve like ). Setelah itu campuran dititrasi dengan CHCl 3
sampai terbentuk 2 lapisan. Terbentuknya 2 lapisan dikarenakan CHCl 3 yang bersifat
nonpolar tidak akan bercampur dengan air yang bersifat polar tetapi sebagian CHCl3
akan terlarut dengan CH3COOH karena sifat CH3COOH yang semipolar. Campuran
H2O dan CH3COOH akan berada di lapisan atas dan campuran CHCl3 dan
CH3COOH akan berada di lapisan bawah. Hal ini dikarenakan perbedaan berat jenis
antara air dan CHCl3 dimana berat jenis CHCl3 lebih besar dari berat jenis air.
Dari hasil yang diperoleh dapat diamati bahwa semakin banyak volume
CH3COOH maka volume CHCl3 yang diperlukan akan semakin banyak juga. Hal ini
dikarenakan jika semakin banyak volume CH3COOH yang bercampur dengan air
maka volume CHCl3 yang dibutuhkan untuk mengikat CH3COOH akan semakin
banyak juga agar dapat terbentuk 2 lapisan.
POLITEKNIK NEGERI SAMARINDA
JURUSAN TEKNIK KIMIA 8
Kelarutan Zat ( Diagram Terner )
BAB 4
PENUTUP
4.1 Kesimpulan
1. Berat jenis H2O yang diperoleh yaitu 0.9852 gram/ml
2. Berat jenis CH3COOH yang diperoleh yaitu 1.0408 gram/ml
3. Berat jenis CHCl3 yang diperoleh yaitu 1.456 gram/ ml
4. CH3COOH akan bercampur dengan H2O dan CHCl3 karena sifatnya yang
semipolar.
5. CHCl3 tidak akan bercampur dengan H2O karena sifat CHCl3 non polar
sedangkan sifat H2O polar
6. Semakin banyak volume CH3COOH yang bercampur dengan air maka
semakin banyak pula volume CHCl3 yang di perlukan agar terbentuk 2
lapisan.
POLITEKNIK NEGERI SAMARINDA
JURUSAN TEKNIK KIMIA 9
Kelarutan Zat ( Diagram Terner )
DAFTAR PUSTAKA
Tim Penyusun. 2010. Penuntun Praktikum Kimia Fisika. Samarinda :
Politeknik Negeri Samarinda
Mustafa.2005. Modul Ajar Kimia Fisika. Samarinda : Politeknik Negeri
Samarinda
Sukardjo. 2002. Kimia Fisika. Jakarta : Rineka Cipta.
POLITEKNIK NEGERI SAMARINDA
JURUSAN TEKNIK KIMIA 10
Kelarutan Zat ( Diagram Terner )
LAMPIRAN
Perhitungan :
Perhitungan massa :
Massa H2O = H2O x v H2O
= 0,9852 x 10 ml
= 9,852 gram
Massa CH3COOH = CH3COOH x v CH3COOH
= 1,0408 x 1 ml
= 1,0408 gram
Massa CHCl3 = CHCl3 x v CHCl3
= 1,456 x 2,2 ml
= 3,2032 gram
POLITEKNIK NEGERI SAMARINDA
JURUSAN TEKNIK KIMIA 11
Kelarutan Zat ( Diagram Terner )
Gambar Alat :
Neraca digital Pipet ukur dan pipet volum
Bulp Gelas Kimia
POLITEKNIK NEGERI SAMARINDA
JURUSAN TEKNIK KIMIA 12
Anda mungkin juga menyukai
- Diagram Fasa TernerDokumen14 halamanDiagram Fasa TernerwitriBelum ada peringkat
- Diagram TernerDokumen15 halamanDiagram TernerSepz Bagoez ZuhermanBelum ada peringkat
- Laporan Praktikum - Diagram TernerDokumen9 halamanLaporan Praktikum - Diagram Ternerhafizh ibnuBelum ada peringkat
- Percobaan X (Diagram Fase)Dokumen9 halamanPercobaan X (Diagram Fase)LuckyZainurRoziqinBelum ada peringkat
- Laporan KesetimbanganDokumen54 halamanLaporan KesetimbanganMutiawalia PutriBelum ada peringkat
- Sistem Zat Cair Tiga KomponenDokumen11 halamanSistem Zat Cair Tiga KomponenHarsiwiCandraSari0% (1)
- Laporan Diagram Terner - Putri Mandaoni PakpahanDokumen23 halamanLaporan Diagram Terner - Putri Mandaoni Pakpahanputri mandaoniBelum ada peringkat
- Laporan Akhir - M1 - 10070221068 - Ayyash Alghifari HDokumen16 halamanLaporan Akhir - M1 - 10070221068 - Ayyash Alghifari HAyyash AhaBelum ada peringkat
- Kelompok 5 Bab 3 Gaya ArchimedesDokumen31 halamanKelompok 5 Bab 3 Gaya ArchimedesRajagnaruk UmakBelum ada peringkat
- Makalah Praktikum Kimia Fisika 1 Kelarutan Dua Cairan Yang Saling Bercampur SebagianDokumen21 halamanMakalah Praktikum Kimia Fisika 1 Kelarutan Dua Cairan Yang Saling Bercampur Sebagiandevy rida100% (1)
- Modul 6 - Kelompok 2 - 12222037Dokumen16 halamanModul 6 - Kelompok 2 - 12222037Afdinal .GBelum ada peringkat
- PTKD Kelompok 3 Kelas A IndralayaDokumen28 halamanPTKD Kelompok 3 Kelas A IndralayaPutra RajasaBelum ada peringkat
- Kelompok 4 - Laporan-Tetap-Campuran-BinerDokumen13 halamanKelompok 4 - Laporan-Tetap-Campuran-BinerTuankho Farras FauzanBelum ada peringkat
- Tugas Kimia FisikaDokumen13 halamanTugas Kimia FisikaGani AbdullahBelum ada peringkat
- Laporan Tetap (Campuran Biner)Dokumen13 halamanLaporan Tetap (Campuran Biner)CCCBelum ada peringkat
- MP 08 TB11 PDFDokumen38 halamanMP 08 TB11 PDFAdhisya Salma KhairunnisaBelum ada peringkat
- TeukuMRafifAlwafi Laprak D1-D2Dokumen14 halamanTeukuMRafifAlwafi Laprak D1-D2Eva SilviaBelum ada peringkat
- DANIEL IVAN RIANTO SIANTURI - KEL4A - CV - SHIFTA - Modul1Dokumen13 halamanDANIEL IVAN RIANTO SIANTURI - KEL4A - CV - SHIFTA - Modul1Aria JonathanBelum ada peringkat
- Laprak Kimfis Kel.1Dokumen10 halamanLaprak Kimfis Kel.1kgstet3Belum ada peringkat
- Laporan Distilasi Biner Kelompok 6 Part DuaDokumen18 halamanLaporan Distilasi Biner Kelompok 6 Part Duarhei718Belum ada peringkat
- Laporan Batch Distillation B-7 FINALDokumen34 halamanLaporan Batch Distillation B-7 FINALmaisaBelum ada peringkat
- Joanne Salres - 011600442 - Laporan Praktikum Tekpem Distilasi PDFDokumen20 halamanJoanne Salres - 011600442 - Laporan Praktikum Tekpem Distilasi PDFJoanne SalresBelum ada peringkat
- Dokumen - Tips Laporan Fasa KesetimbanganDokumen16 halamanDokumen - Tips Laporan Fasa KesetimbanganM Khadafi YBelum ada peringkat
- Diagram Fasa TernerDokumen20 halamanDiagram Fasa TernerwitriBelum ada peringkat
- Laporan K1Dokumen15 halamanLaporan K1ikepurwantiBelum ada peringkat
- Diagram TernerDokumen9 halamanDiagram TernerditaBelum ada peringkat
- Percobaan 10 PDFDokumen16 halamanPercobaan 10 PDFEpriella PuteriBelum ada peringkat
- Laporan Fisika Dasar Hukum Utama HidrostatisDokumen13 halamanLaporan Fisika Dasar Hukum Utama Hidrostatisnggaysptn2Belum ada peringkat
- LKPD Sifat Koligatif LarutanDokumen8 halamanLKPD Sifat Koligatif LarutanAnnisa AfriantiBelum ada peringkat
- E2 - Kelarutan Timbal Balik CicaDokumen14 halamanE2 - Kelarutan Timbal Balik Cica016 Cica Siti NurjanahBelum ada peringkat
- Laporan Praktikum EccDokumen18 halamanLaporan Praktikum Ecc14 - Devina Maharani [03]Belum ada peringkat
- Deatilasi FraksinasiDokumen12 halamanDeatilasi Fraksinasiwilda ulin nuhaBelum ada peringkat
- Kurang Grafik Campuran Biner I (KIMFIS)Dokumen12 halamanKurang Grafik Campuran Biner I (KIMFIS)Nur Annisa YuliasdiniBelum ada peringkat
- Laporan Massa Jenis ZatDokumen15 halamanLaporan Massa Jenis Zatkesha aditya67% (6)
- Laporan Yang Arlin BuatDokumen15 halamanLaporan Yang Arlin BuatheruhermawanBelum ada peringkat
- Zico Daniel Despen Sihombing - 01 - 4Dokumen34 halamanZico Daniel Despen Sihombing - 01 - 4zddespen07Belum ada peringkat
- Laprak DistilasiDokumen12 halamanLaprak DistilasifatimahBelum ada peringkat
- Laprak E3 JessDokumen8 halamanLaprak E3 JessSamsungs9 Iphone11Belum ada peringkat
- LAPTAP Fasa KesetimbanganDokumen16 halamanLAPTAP Fasa KesetimbangananastasyaBelum ada peringkat
- Kelompok 4Dokumen2 halamanKelompok 4evinBelum ada peringkat
- Laprak DistilasiDokumen24 halamanLaprak DistilasiAlfarizBelum ada peringkat
- Laporan Tetap Campuran Biner 1Dokumen13 halamanLaporan Tetap Campuran Biner 1Bagas Pratama II100% (1)
- Energi Kesetimbangan Fasa (1112016200038)Dokumen10 halamanEnergi Kesetimbangan Fasa (1112016200038)Christopher Herman100% (3)
- Jurnal Praktikum 8Dokumen9 halamanJurnal Praktikum 8Putu AstiniBelum ada peringkat
- Laporan D1 D2 Sifat Koligatif LarutanDokumen13 halamanLaporan D1 D2 Sifat Koligatif LarutanAirlangga Diandra Putra100% (6)
- 04penatap Partikel TanahDokumen7 halaman04penatap Partikel TanahW GiBsonBelum ada peringkat
- Laporan Praktikum Kimia Fisika 2 Energi PDFDokumen10 halamanLaporan Praktikum Kimia Fisika 2 Energi PDFHANUM MULYA 22TKM589Belum ada peringkat
- Laporan Praktikum Diagram TernerDokumen14 halamanLaporan Praktikum Diagram TernerRosalya MarbunBelum ada peringkat
- Diagram Terner 1Dokumen20 halamanDiagram Terner 1Maisa UlfahBelum ada peringkat
- Massa JenisDokumen15 halamanMassa JenisFarisdaBelum ada peringkat
- Diagram Terner Sistem 3 KomponenDokumen10 halamanDiagram Terner Sistem 3 KomponenElvina Laksmi KhairunisaBelum ada peringkat
- Kbi Kelompok 5Dokumen15 halamanKbi Kelompok 5Rifa SafitriBelum ada peringkat
- Laporan Tugas Praktikum Simulasi Proses Teknik Kimia PVT AnalysisDokumen11 halamanLaporan Tugas Praktikum Simulasi Proses Teknik Kimia PVT AnalysisMUHAMMAD FATHI RIZQILLAHBelum ada peringkat
- RektifikasiDokumen9 halamanRektifikasiindah dwi lestariBelum ada peringkat
- Laporan Praktikum Simulasi Proses 1-1Dokumen13 halamanLaporan Praktikum Simulasi Proses 1-1MUHAMMAD FATHI RIZQILLAHBelum ada peringkat
- LP - Ana Lailatul Farida - 105118027 - Modul 3Dokumen13 halamanLP - Ana Lailatul Farida - 105118027 - Modul 3Ana Lailatul faridaBelum ada peringkat
- Penentuan Berat Molekul Melalui Metode Penurunan Titik Beku FixDokumen15 halamanPenentuan Berat Molekul Melalui Metode Penurunan Titik Beku FixYunita Dwi LarasatiBelum ada peringkat
- Pembahasan Diagram TernerDokumen3 halamanPembahasan Diagram TernerAdi Sagitarius100% (1)
- Makalah BioprosesDokumen26 halamanMakalah BioprosesSelvia WidyawatiBelum ada peringkat
- Flow Control Insyallah Tanpa RevisiDokumen25 halamanFlow Control Insyallah Tanpa RevisiSelvia WidyawatiBelum ada peringkat
- Flow Control Insyallah Tanpa RevisiDokumen25 halamanFlow Control Insyallah Tanpa RevisiSelvia WidyawatiBelum ada peringkat
- Grafik Tray DrayerDokumen2 halamanGrafik Tray DrayerSelvia WidyawatiBelum ada peringkat
- BAB I Control Temprtur 2Dokumen27 halamanBAB I Control Temprtur 2Selvia WidyawatiBelum ada peringkat
- PCT 42 PH Control (Repaired)Dokumen10 halamanPCT 42 PH Control (Repaired)Selvia WidyawatiBelum ada peringkat
- PCT 42 PH Control (Repaired)Dokumen3 halamanPCT 42 PH Control (Repaired)Selvia WidyawatiBelum ada peringkat
- BAB I Control Temprtur 2Dokumen26 halamanBAB I Control Temprtur 2Vian Galih SaputraBelum ada peringkat
- Tugas NikenDokumen3 halamanTugas NikenSelvia WidyawatiBelum ada peringkat
- Diagram TernerDokumen20 halamanDiagram TernerSelvia Widyawati100% (1)
- ARRHENIUSDokumen22 halamanARRHENIUSSelvia WidyawatiBelum ada peringkat