Amina
Diunggah oleh
DitoAPrasetyoJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Amina
Diunggah oleh
DitoAPrasetyoHak Cipta:
Format Tersedia
AMINA TUJUAN Untuk mengetahui uji-uji spesifik amina.
. Untuk membedakan amina alifatis dan amina aromatis Untuk membedakan amina primer dan amina sekunder. TEORI DASAR
1. Pengertian Amina adalah senyawa organic yang mengandung atom nitrogen trivalent yang mengandung atom nitrogen trivalen yang berkaitan dengan satu atau dua atau tiga atom karbon, dimana amina juga merupakan suatu senyawa yang mengandung gugusan amino (-NH2, - NHR, atau NH2). Gugusan amino mengandung nitrogen terikat, kepada satu sampai tiga atom karbon (tetapi bukan gugusan karbonil). Apabila salah satu karbon yang terikat pada atom nitrogen adalah karbonil, senyawanya adalah amida, bukan amina.
2. Ciri Khas Di antara sejumlah golongan senyawa organic yang memiliki sifat basa, yang terpenting adalah amina. Di samping itu sejumlah amina memiliki keaktifan faali (fisiologis), misalnya efedrina berkhasiat sebagai peluruh dahak, meskalina yang dapat mengakibatkan seseorang berhalusinasi, dan amfetamina yang mempunyai efek stimulant. Kelompok senyawa alkaloid yang berasal dari tumbuhan secara kimia juga meripakan bagian dari golongan basa organic amina. 3. Runus Umum Rumus umum untuk senyawa amina adalah : RNH2 R2NH R3N: Dimana R dapat berupa alkil atau ari B. Struktur Amina merupakan senyawa organik yang terpenting dalam kehidupan sehari-hari dan memiliki urutan yang paling penting dalam senyawa organik, oleh karena itu amina tidak terlepas dari semua unsur organik yang lain. Oleh karena itu sifat-sifat yang di pelajari dalam senyawa amina akan sangat membantu dalam memahami aspek kimiawi kelompok alkoid yang mempunyai peran pentig dalam pembuatan obat-obat sinetik dewasa ini. C. Tata Nama Tata Nama IUPAC (Sistematik) Nama sistematik untuk amina alifatik primer diberikan dengan cara seperti nama sistematik alkohol, monohidroksi akhiran a dalam nama alkana induknya diganti oleh kata amina Contoh : CH3- CH-CH3 2-propanamina NH2
CH3-CH2-CH-CH2-CH3 3-pentanamina NH3 Untuk amina sekunder dan tersier yang asimetrik (gugus yang terikat pada atom N tidak sama), lazimnya diberi nama dengan menganggapnya sebagai amina primer yang tersubtitusi pada atom N. Dalam hal ini berlaku ketentuan bahwa gugus sustituen yang lebih besar dianggap sebagai amina induk, sedangkan gugus subtituen yang lebih kecil lokasinya ditunjukkan dengan cara menggunakan awalan N (yang berarti terikat pada atom N) Contoh : CH3 N CH3 N3N-dimetilsikopentamina
Tata Nama Trivial Nama trivial untuk sebagian besar amina adalah dengan menyebutkan gugus-gugus alkil/aril yang terikat pada atom N dengan ketentuan bahwa urutan penulisannya harus memperhatikan urutan abjad huruf terdepan dalam nama gugus alkil/aril kemudian ditambahkan kata amina di belakang nama gugus-gugus tersebut Contoh : CH3 CH3NH2 CH C NH2 CH3 Metilamina tersier-butilamina D. Klasifikasi Amina digolongkan menjadi amina primer (RNH2), sekunder (R2NH), atau tersier (R3N), tergantung kepada jumlah atom karbon yang terikat pada atom nitrogen (bukan pada atom karbon, seperti pada alkohol) Beberapa (10) Amin Primer (suatu karbon Terikat kepada N) CH3 CH3NH2 CH3 C NH2 NH2 CH3 Beberapa (20) Amin sekunder (Dua Korbon terikat kepadaN)
CH3 NH CH3 NHCH3 N H Beberapa (30) Amin Tersier (Tiga karbon Terkait kepada N): CH CH3 N CH3 N CH3 N CH3 E. Sifat-Sifat Amina 1. Sifat Kimia Kebasaan Seperti halnya amonia, semua amina bersifat sebagai basa lemah dan larutan amina dalam air bersifat basis Contoh : H CH3N: + H O- H CH3- N- H + HO H Metilamonium hidroksida [CH3NH3][HO] Kb = = 4,37 10-4 [CH3NH2] Harga pKb untuk CH3NH2 = - log Kb = 3,36 Untuk menelaah kebasaan suatu amina, sering kali digunakan acuan tetapan ionisasi konjugatnya (Ka). Untuk asam konjugat dari CH3NH2 yaitu CH3NH3+ harga tetapan ionisasi asamnya adalah : CH3NH3+ CH3NH2 + H+ [CH3NH2][H+] Ka = = 4,37x10 [CH3NH3+] Harga pKa untuk CH3NH3+ = -log Ka = 10,64 Harga pKa dan pKb untuk pasangan asam basa konjugat dinyatakan dengan persamaan: pKa + pKb =14 Reaksi Amina dngan Asam Amina yang larut maupun yang tidak larut dalam air dapat bereaksi dengan asam dan menghasylkan garam yang larut dalam air. Contoh :
(CH3CH2)2NH + HCl (CH3CH2)2NH2+Cldietilamonium klorida 2. Sifat Fisik Contoh : HH ROH:OR R2NH :NR2
5 kcal/mol 3kcal/mol Titik didih dari amina yang mengandung suatu ikatan NH adalah ditengah-tengah antara alkana (tidak ada ikatan hidrogen) dan alcohol (ikatan alcohol kuat) CH3CH2CH3 CH3CH2NH2 CH3CH2OH propana Etilamina Etanol Berat rumus : 44 45 46 Titik didh (C): -42 17 78,5 Titik didih dari amina yang tidak mengandung ikatan NH, jadi tidak mempunyai ikatan hidrogen, lebih rendah dari amina yang mempunyai ikatan hidrogen. F. Reaksi-Reaksi Amina Reaksi Amina dengan Asam Nitrit 1. Amina alifatik primer dengan HNO2 menghasilkanalkohol disertai pembebasan gas N2 menurut persamaan reaksi di bawah ini : CH3-CH-NH2 + HNO2 CH3-CH-OH + N2 + H2O CH3 CH3 Isopropilamina (amina 1) isopropil alkohol (alkohol 2) 2. Amina alifatik/aromatik sekunder dengan HNO2 menghasilkan senyawa N-nitrosoamina yang mengandung unsur N-N=O Contoh : H N=O N + HNO2 N + H2O CH3 CH3 N-metilanilina N-metilnitrosoanilina
3. Amina alifatik/aromatik dengan HNO2 memberikan hasil reaksi yang ditentukkan oleh jenus amina tersier yang digunakan. Pada amina alifatik/aromatik tersier reaksinya dengan HNO2 mengakibatkan terjadinya sustitusi cincin aromatik oleh gugus NO seperti contoh dibawah ini CH3 CH2
N + HNO2 N + H2O CH3 CH3 N,N-dietilanilina p-nitroso N,N- dimetilanilina 4. Amina aromatik primer jika direaksikan dengan HNO2 pada suhu 0C menghasilkan garam diazonium Contoh : + NH2 + HNO2 + HCl N= : Cl + 2H2O Anilina benzenadiaazonium klorida Reaksi Amina dengan Asam Contoh : (CH3CH2)2NH + HCl (CH3CH2)2NH+ClDietilamonium klorida G. Pembuatan Amina Ada dua jalan umumuntuk pembentukan amina yaitu subtitusi dan reduksi. Reaksi Subtitusi dari Alkil Halida Ammonia dan mengandung pasangan elektron sunyi pada atom nitrogen, oleh sebab itu, senyawa itu dapatbertindak sebagai nukleofil dalm reaksi subtitusi nukleofilik dari alkil halida. Reaksi dengan amonia menghasilkan garam dari amin primer. Bila garam amina ini direaksikan dengan basa akan dibebaskan amina bebas. Reaksi alkil halida dengan amina dan bukan amonia akan menghasilkan amin sekunder, tersier, atau garam amonium kuarterner, tergantung pada amina yang digunakan. + CH3CH2Br + CH3CH2 CH3CH2NH2CH3 Br - - OH CH3CH2NH2CH3 10 amina 20 amina + CH3CH2Br + (CH3)2 NH CH3CH2NH2 (CH3)2 Br - - OH 20 amina CH3CH2N(CH3)2 30 amina CH3CH2Br + (CH3)3 N CH3CH2N(CH3)2 Reaksi Reduksi dari Senyawa Nitrogen lain Reduksi dari amida atau nitril dengan litium aluminium hidrida atau dengan gas hidrogen (hidrogenasi katalitik) menghasilkan amina. Dengan amida, amin primer, sekunder, atau tersier bisa didapat, tergantung kepada jumlah substitusi pada amida nitrogen. Amida yang disubtitusi CH3CH2CH2 C N CH3CH2CH2- CH2NH2 Nitril 1amina
PROSEDUR KERJA A. ALAT Tabung reaksi Rak tabung reaksi Gelas piala Pipet tetes Bunsen Kaki tiga B. BAHAN Metilamina Dimetilamina Anilina HCl 2 N Batu es NaNO3 10 % Aseton Natrium Nitropusid 1 % NaOH dalam Alkohol 0,5 M CHCl3 Benzen Sulfanil Klorida Kertas lakmus C. CARA KERJA 1. Tes Kebasaan Masukkan sampel ke dalam tabung reaksi. Celupkan kertas lakmus dan amati. 2. Reaksi dengan Asam Nitrit Isi tabung reaksi dengan 2 ml sampel yang telah disediakan. Tambahkan 5 ml HCl 2 N dan dinginkan dalam es. Tambahkan 2 ml NaNO2 10 % ,panaskan perlahan lahan dalam penangas air. Adanya gas N2 menandakan tes positif (+) amina alifatis. 3. Tes Karbilamin Ke dalam 1 ml NaOH dalam Alkohol 0,5 M dimasukkan 0,1 gr amina dan 3 tetes kloroform. Panaskan sampai mendidih dalam penangas air. Karbilamina akan terbentuk dan menimbulkan bau busuk. 4. Reaksi dengan Benzen Sulfanil Klorida. Isikan sampel yang telah disediakan ke dalam tabung reaksi. Ditambahkan 1 ml Benzensulfanilklorida. Amati, bila timbul endapan putih ditambahkan NaOH 10 % dan amati.
D. SKEMA KERJA 1. Tes Kebasaan
+ Kertas lakmus ( ikatan lakmus) Sampel 2. Reaksi dengan Asam Nitrit
amati
+ HCl 2N + NaNO2 10 %, Sampel 3. Tes Karbilamin
dinginkan timbul gas N2 (+)
+ NaOH dalam Alkohol + 0,1 g amina + CHCl3 Sampel 4. Reaksi dengan Benzensulfanilklorida
bau busuk
+ 1ml Benzensulfanilklorida Sampel PENGAMATAN NO URAIAN 1 Tes Kebasaan REAKSI Metilamina + kertas lakmus Dimetilamina + kertas lakmus Anilin + kertas lakmus 2. Reaksi dengan asam nitrit H3C-NH2+ HNO2 N2
Putih + NaOH 10 %, amati
PENGAMATAN Biru Biru Biru
KET + + + +
H3C-OH+
Gelembung gas
H3C-NH2-H3C+ HNO2 H3C-N-NO + N2 + H2O CH3
Gelembung gas
Anilin + HNO2 N2/ + H2O 3 Tes Karbilamin H3C-NH2 +CHCl3+ 3 NaOH H3CNC+3 KCl +H2O
Gelembung gas
Bau Busuk
H3C-NH2-H3C +CHCl3+3NaOH (CH3)2 NC + KCl+3 H2O
Bau busuk
Bau Busuk +CHCl3+3NaOH NC7 +3KCl + H2O 4. Reaksi dengan Metilamina+ Benzensulfanilklorida Benzensulfanilklorida putih + NaOH Dimetilamina + Benzensulfanilklorida Putih + NaOH Endapan putih Endapan Endapan putih Endapan Endapan putih
Anilin + Benzensulfanilklorida Endapan putih + NaOH
PEMBAHASAN Asam nitrit dapay dibuat dari HCl dan NaNO2 dengan persamaan: NaNO2 + HCl HNO2 + NaCl Adanya gelembung gas ditunjukkan oleh adanya gas N2 .Hal ini dapat ditunjukkan pada reaksi-reaksi diatas . Gas N2 ini menunjukkan amina aromatik.
Senyawa Karbilamin menyebabkan bau busuk seperti bau karbit. KESIMPULAN Amina bersifat basa lemah. Hal ini ditunjukkan dengan kertas lakmus yang dicelupkan berubah menjadi warna biru. Amina yang bereaksi dengan Asam nitrit akan menghasilkan gas N2 . Apabila amina direaksikan dengan NaOH dalam Alkohol dan ditambahkan kloroform akan terbentuk suatu karbilamin yang menimbulkan bau bususk seperti bau karbit. DAFTAR PUSTAKA http://www.scribd.com/doc/50097221/AMINA-docx-penting Nafis , A dan Armin, M I .2003. Bahan Ajar Kimia Organik Padang.ATIP http://id.wikipedia.org/wiki/Amina
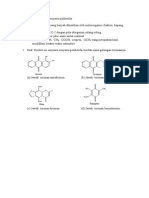
JAWABAN PERTANYAAN 1. Struktur amina Metil amina : CH3- NH2 Dimetilamina: H3C-NH-CH3 Anilin :
2. Garam Diazonium Adalah Garam diazonium adalah senyawa organik yang diperoleh dari reaksi suatu amina aromatik primer yang dilarutkan atau disuspensikan dalam suatu larutan asam mineral dalam air, kemudian direaksikan dengan kalium nitrit dalam keadaan dingin. Jika ditinjau dari sudut pandang sintesis senyawa organik, garam diazonium mempunya arti penting karena dari senyawa tersebut dapat dibuat berbagai senyawa aromatik. Proses Diazotisasi Adalah proses pembuatan gugus N-H-.Misalnya pada reaksi suatu amina aromatis.
Anda mungkin juga menyukai
- Kinetika Inaktivasi BakteriDokumen2 halamanKinetika Inaktivasi BakteriEko PrastiyoBelum ada peringkat
- Laporan 10 AnaDokumen13 halamanLaporan 10 AnaAndrianaNurAiniBelum ada peringkat
- M1 - LiquidDokumen8 halamanM1 - LiquidRaden Azzaha Aura ABelum ada peringkat
- Natrium PentobarbitalDokumen2 halamanNatrium Pentobarbitalerika minBelum ada peringkat
- ViskomitaDokumen15 halamanViskomitaNabilAH NabilAHBelum ada peringkat
- Studi Kuantum Farmakologi Senyawa Turunan Sulfonamida 2,4 Diamino 6 Quinazoline Sebagai Antimalaria Dengan Menggunakan Metode Ab InitioDokumen5 halamanStudi Kuantum Farmakologi Senyawa Turunan Sulfonamida 2,4 Diamino 6 Quinazoline Sebagai Antimalaria Dengan Menggunakan Metode Ab InitioRicky RafinaldiBelum ada peringkat
- THERE - Algoritma CHFDokumen1 halamanTHERE - Algoritma CHFNovema AsharBelum ada peringkat
- LAPORAN IDENTIFIKASI ANTRAKUINON Dengan KLTDokumen14 halamanLAPORAN IDENTIFIKASI ANTRAKUINON Dengan KLTMeylania Citra Dewi100% (1)
- Contoh Senyawa Seskuiterpen TrisiklikDokumen3 halamanContoh Senyawa Seskuiterpen TrisiklikAmelia SoyataBelum ada peringkat
- Uji Triterpen Dan SteroidDokumen3 halamanUji Triterpen Dan SteroidAdi NugrahaBelum ada peringkat
- Jurnal Penetapan Kadar Etanol Dalam Sampel Obat Eliksir Dengan GC-PKT 36-XIII.5-DysprosinaDokumen4 halamanJurnal Penetapan Kadar Etanol Dalam Sampel Obat Eliksir Dengan GC-PKT 36-XIII.5-DysprosinaSarahMaulina100% (1)
- Hidrokuinon Analitik2ADokumen21 halamanHidrokuinon Analitik2AFahmi Puteri Perdani100% (1)
- Lamp IranDokumen5 halamanLamp IranNadia Hyocyamii Part IIBelum ada peringkat
- Wujud Dan Kesetimbangan Fase PDFDokumen21 halamanWujud Dan Kesetimbangan Fase PDFfahriz hibatullahBelum ada peringkat
- Laporan Prak - SolidDokumen18 halamanLaporan Prak - Solidvitri viantiBelum ada peringkat
- AsmaDokumen12 halamanAsmaAndikaBramantyaSBelum ada peringkat
- Uji Sediaan Mikrobiologi Farmasi FeraDokumen40 halamanUji Sediaan Mikrobiologi Farmasi FeraNadiiya Ananta Malape100% (1)
- Protokol Validasi Metode Analisis - Desoximetasone 160318Dokumen10 halamanProtokol Validasi Metode Analisis - Desoximetasone 160318Dwi Febri KurniawanBelum ada peringkat
- Pembuatan Tissue Plasminogen ActivatorDokumen7 halamanPembuatan Tissue Plasminogen ActivatorNerviRita100% (2)
- Bahan Diskusi Sterilisasi IpedDokumen19 halamanBahan Diskusi Sterilisasi IpeddeviayularasatiBelum ada peringkat
- Kimia Farmasi - Penentuan Kadar Senyawa Obat Secara SimultanDokumen9 halamanKimia Farmasi - Penentuan Kadar Senyawa Obat Secara SimultanAlganBelum ada peringkat
- Pengawetan Produk Pangan Dalam Bidang FarmasiDokumen3 halamanPengawetan Produk Pangan Dalam Bidang FarmasiNira Dwi AnggraeniBelum ada peringkat
- Uji Stabilitas Fisik Formula Krim Yang Mengandung EkstrakDokumen15 halamanUji Stabilitas Fisik Formula Krim Yang Mengandung EkstrakerlanggawidyaputriBelum ada peringkat
- Kadar Air FarmakognosiDokumen10 halamanKadar Air FarmakognosiChintya JessicaBelum ada peringkat
- Pembuatan Tablet Hisap Vitamin C Menggunakan Kombinasi Laktosa Dan Dekstrin Secara Cetak LangsungDokumen93 halamanPembuatan Tablet Hisap Vitamin C Menggunakan Kombinasi Laktosa Dan Dekstrin Secara Cetak Langsungsiti aminahBelum ada peringkat
- 13010046-Asam LinoleatDokumen2 halaman13010046-Asam LinoleatYolanda Winarny Eviphanie HutabaratBelum ada peringkat
- AlkaloidDokumen7 halamanAlkaloidAnonymous xiqruCXMBelum ada peringkat
- Pengembangan Obat OK PDFDokumen26 halamanPengembangan Obat OK PDFReza Dwi SaputraBelum ada peringkat
- LAPORAN Aspirin Kafein MEYDokumen21 halamanLAPORAN Aspirin Kafein MEYEstiningtyas Kusuma WardaniBelum ada peringkat
- Rekayasa ProtenDokumen10 halamanRekayasa Protenrika nurjanahBelum ada peringkat
- Esofhagus (Kerongkongan)Dokumen5 halamanEsofhagus (Kerongkongan)Novi SetyaningsihBelum ada peringkat
- Studi Kasus TiroidDokumen2 halamanStudi Kasus TiroidNur UfiyaBelum ada peringkat
- Firdah Analisis Farmasi II DestilasiDokumen12 halamanFirdah Analisis Farmasi II DestilasifirdaBelum ada peringkat
- KIMFISDokumen9 halamanKIMFISzahra zelviraBelum ada peringkat
- Terapi AntidotDokumen22 halamanTerapi AntidotNananinaBelum ada peringkat
- Standarisasi SimplisiaDokumen3 halamanStandarisasi SimplisiaI Nyoman Raimarta WigunaBelum ada peringkat
- Stabilitas ObatDokumen6 halamanStabilitas ObatMuhammad RamadhanBelum ada peringkat
- Penentuan Kadar MentolDokumen10 halamanPenentuan Kadar MentolFastabiqul KhairatBelum ada peringkat
- Biofarmasetika (BCS)Dokumen4 halamanBiofarmasetika (BCS)SelynitaBelum ada peringkat
- Spektrofotometri Uv-VisDokumen47 halamanSpektrofotometri Uv-VisIhans23Belum ada peringkat
- Solusi Creaming, Inverse Fase, KoalesensiDokumen1 halamanSolusi Creaming, Inverse Fase, KoalesensiMarzina GonsalvesBelum ada peringkat
- FarmakognosiDokumen11 halamanFarmakognosisywaltBelum ada peringkat
- Identifikasi Metabolit SekunderDokumen13 halamanIdentifikasi Metabolit SekunderSulton UlfadhaBelum ada peringkat
- Makalah Kelompok 1. Manajemen KeuanganDokumen22 halamanMakalah Kelompok 1. Manajemen KeuanganMcKnightBelum ada peringkat
- Skrining FitokimiaDokumen33 halamanSkrining FitokimiaArroh NurulaynyBelum ada peringkat
- ELIKSIR Sediaan FarmasiDokumen18 halamanELIKSIR Sediaan FarmasiRelinYesikaBelum ada peringkat
- Pengertian Senyawa AminaDokumen10 halamanPengertian Senyawa AminaFauzi RachmanBelum ada peringkat
- Formulasi Dan Evaluasi Krim Pelembab Menggunakan Almond ButterDokumen4 halamanFormulasi Dan Evaluasi Krim Pelembab Menggunakan Almond ButterHasnawati H. ThalibBelum ada peringkat
- Kel 3 - Intranasal Dan Intrapulmonal - Biofarmasetika ADokumen98 halamanKel 3 - Intranasal Dan Intrapulmonal - Biofarmasetika APuji Fitria NoviyaniBelum ada peringkat
- Aprilia Syafrani - Kimia Organik II - Pemurnian AlkoholDokumen9 halamanAprilia Syafrani - Kimia Organik II - Pemurnian AlkoholAprilia SyafraniBelum ada peringkat
- Makalah Sintesis Obat FixDokumen12 halamanMakalah Sintesis Obat Fixressy krisbellaBelum ada peringkat
- Flavonoid 2021Dokumen41 halamanFlavonoid 2021Niluh SuartiniBelum ada peringkat
- Soal Jawaban UTS KBADokumen1 halamanSoal Jawaban UTS KBANurma Erlita DamayantiBelum ada peringkat
- Penentuan Kerapatan Dan Bobot JenisDokumen19 halamanPenentuan Kerapatan Dan Bobot Jenissiti masrurohBelum ada peringkat
- Laporan Metil EsterDokumen12 halamanLaporan Metil EsterDwi Julia Armi IIBelum ada peringkat
- Elusidasi StrukturDokumen5 halamanElusidasi StrukturIke KidamBelum ada peringkat
- Tugas Kimia OrganikDokumen10 halamanTugas Kimia OrganikFathur Rahman YusufBelum ada peringkat
- AMINA - Docx Penting !Dokumen5 halamanAMINA - Docx Penting !Titis SwastikaBelum ada peringkat
- Amina Dan TurunannyaDokumen11 halamanAmina Dan TurunannyaDonitha Fausiahh JamilBelum ada peringkat
- Amina AmidaDokumen12 halamanAmina Amidaaditya sekar100% (1)
- ) Dengan Metode Six Sigma Di Pt. Petrokimia Gresik TBK.: Analisis Kualitas Produk Aluminium Fluorida (AlfDokumen19 halaman) Dengan Metode Six Sigma Di Pt. Petrokimia Gresik TBK.: Analisis Kualitas Produk Aluminium Fluorida (AlfDitoAPrasetyoBelum ada peringkat
- 2650 10262 1 PBDokumen8 halaman2650 10262 1 PBDitoAPrasetyoBelum ada peringkat
- 8027 24091 1 SMDokumen9 halaman8027 24091 1 SMDitoAPrasetyoBelum ada peringkat
- File 1Dokumen8 halamanFile 1DitoAPrasetyoBelum ada peringkat
- Tanpa JudulDokumen1 halamanTanpa JudulDitoAPrasetyoBelum ada peringkat
- Pembuatan Aspirin DapDokumen11 halamanPembuatan Aspirin DapDitoAPrasetyoBelum ada peringkat
- ) Dengan Metode Six Sigma Di Pt. Petrokimia Gresik TBK.: Analisis Kualitas Produk Aluminium Fluorida (AlfDokumen19 halaman) Dengan Metode Six Sigma Di Pt. Petrokimia Gresik TBK.: Analisis Kualitas Produk Aluminium Fluorida (AlfDitoAPrasetyoBelum ada peringkat
- KARBOHIDRATDokumen15 halamanKARBOHIDRATDitoAPrasetyoBelum ada peringkat
- TUJUANDokumen17 halamanTUJUANDitoAPrasetyoBelum ada peringkat
- Pembuatan Amil Asetat MahDokumen9 halamanPembuatan Amil Asetat MahDitoAPrasetyoBelum ada peringkat
- ProteinDokumen4 halamanProteinDitoAPrasetyoBelum ada peringkat
- TujuanDokumen10 halamanTujuanDitoAPrasetyoBelum ada peringkat
- Sintesis Metil Salisilat MahDokumen11 halamanSintesis Metil Salisilat MahDitoAPrasetyoBelum ada peringkat
- Kar Bok SilatDokumen11 halamanKar Bok SilatDitoAPrasetyoBelum ada peringkat
- KARBONILDokumen9 halamanKARBONILDitoAPrasetyoBelum ada peringkat
- Destilasi UapDokumen9 halamanDestilasi UapDitoAPrasetyoBelum ada peringkat
- SokletasiDokumen8 halamanSokletasiDitoAPrasetyoBelum ada peringkat
- AminaDokumen8 halamanAminaDitoAPrasetyoBelum ada peringkat
- Destilasi NormalDokumen12 halamanDestilasi NormalDitoAPrasetyoBelum ada peringkat
- TUJUANDokumen17 halamanTUJUANDitoAPrasetyoBelum ada peringkat
- Cover 2Dokumen1 halamanCover 2Fakhri Al JenarBelum ada peringkat
- Destilasi Normal (Air Tapai)Dokumen4 halamanDestilasi Normal (Air Tapai)DitoAPrasetyo0% (1)
- HTTP Kim PangDokumen1 halamanHTTP Kim PangDitoAPrasetyoBelum ada peringkat
- ProteinDokumen10 halamanProteinDitoAPrasetyoBelum ada peringkat
- Kolorimetri Standar Seri DAP 01Dokumen7 halamanKolorimetri Standar Seri DAP 01DitoAPrasetyoBelum ada peringkat
- AldolDokumen2 halamanAldolDitoAPrasetyoBelum ada peringkat
- Kemiripan Antara Reaksi-Reaksi: Perbandingan Struktur Air, Etanol, Dan FenolDokumen5 halamanKemiripan Antara Reaksi-Reaksi: Perbandingan Struktur Air, Etanol, Dan FenolDitoAPrasetyoBelum ada peringkat
- Aldol KondensasiDokumen6 halamanAldol KondensasiDitoAPrasetyoBelum ada peringkat
- Manisan BuahDokumen8 halamanManisan BuahDitoAPrasetyoBelum ada peringkat
- Bundelan KO DN12Dokumen8 halamanBundelan KO DN12DitoAPrasetyoBelum ada peringkat