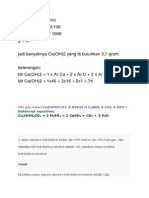
Menentukan Rumus Empiris Dan Rumus Molekul
Diunggah oleh
st nurdia hasmaHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Menentukan Rumus Empiris Dan Rumus Molekul
Diunggah oleh
st nurdia hasmaHak Cipta:
Format Tersedia
Menentukan Rumus Empiris Dan Rumus Molekul
Rumus Kimia
Seperti yang telah disinggung rumus kimia merupakan salah satu ciri khas senyawa
kimia. Rumus kimia suatu senyawa menyatakan lambang dan jumlah atom unsur yang
menyusun suatu senyawa tanpa menyebut senyawa tersebut termasuk senyawa ionik atau
kovalen. Rumus kimia sendiri terbagi menjadi rumus empiris dan rumus molekul.
Rumus molekul dan rumus empiris suatu senyawa hanya terjadi perbedaan jumlah
atom, sedangkan atom unsur penyusun senyawa tetap. Namun demikian beberapa senyawa
memiliki rumus molekul dan rumus empirisnya yang sama, misalnya H2O (air) dan NH3
(amoniak).
Jumlah atom dalam suatu rumus kimia menyatakan jumlah mol dari unsur terkait, jadi
rumus kimia suatu senyawa merupakan perbandingan mol atom unsur penyusun senyawa
tersebut. Dari perbandingan atom atau perbandingan mol ini dapat ditentukan perbandingan
massa dan % massa dari unsur-unsur yang menyusun senyawa tersebut.
Untuk memperjelas hal ini perhatikan contoh berikut! misalnya vitamin C yang
mengandung asam askorbat dengan rumus molekul C6H8O6, maka:
· Rumus molekul C6H8O6
· Perbandingan mol atom unsur
C:H:O=6:8:6
· Perbandingan massa unsur
C : H : O = 6 x Ar. C : 8 x Ar.H : 6 x Ar.O
= (6 x 12) : (8 x 1) : (6 x 16)
= 72 : 8 : 96
· Jumlah perbandingan = Mr
72 + 8 + 96 = 176
· % massa masing-masing unsur
Berikut adalah rumus untuk menghitung % massa unsur dalam senyawa
Rumus Empiris dan Rumus Molekul
Rumus Empiris
Rumus empiris adalah rumus kimia yang menyatakan perbandingan terkecil jumlah
atom-atom pembentuk senyawa. Misalnya senyawa etena yang memiliki rumus molekul C2H4,
maka rumus empiris senyawa tersebut adalah CH2.
Dalam menentukan rumus empiris yang dicari terlebih dahulu adalah massa atau
persentase massa dalam senyawa, kemudian dibagi dengan massa atom relatif (Ar) masing-
masing unsur. artinya untuk menentukan rumus empiris yang perlu dicari adalah perbandingan
mol dari unsur-unsur dalam senyawa tersebut.
Contoh
Suatu senyawa mengandugn 64,6 g natrium, 45,2 g belerang dan 90 g oksigen. Jika diketahui
Ar.N = 23, Ar.S = 32, ddan Ar.O = 16. Maka tentukan rumus empiris senyawa tersebut?
Jawab
Jadi rumus empiris senyawa tersebut adalah Na2SO4.
Rumus Molekul
Rumus molekul adalah rumus kimia yang menyatakan jenis dan jumlah atom yang
menyusun suatu senyawa. Misalnya: C2H4 (etena), CO(NH2)2 (urea) dan asam asetat atau asam
cuka (CH3COOH). Rumus molekul dapat didefinisikan sebagai rumus kimia yang menyatakan
perbandingan jumlah dan jenis atom sesungguhnya dari suatu senyawa.
Dari rumus molekul asam cuka diketahui bahwa rumus molekul tersebut tidak ditulis
C2H4O2. Beberapa alasan rumus molekul asam cuka tidak ditulis demikian yaitu
1. Untuk membedakan dengan senyawa lain yang memiliki jumlah atom penyusun yang sama
misalnya metil format (HCOOCH3).
2. Rumus molekul menggambarkan struktur molekul. Artinya dari rumus molekul kita dapat
menunjukan atom-atom saling berikatan. Pada molekul asam cuka atom C yang pertama
mengikat 3 atom H dan 1 atom C berikutnya dan atom C berikunya mengikat 2 atom O
kemudian 1 atom O mengikat 1 atom H.
Contoh soal menentukan rumus molekul dari rumus empiris
200 g senyawa organik mempunyai massa molekul relatif = 180, senyawa ini terdiri
dari 40% karbon, 6,6% hidrogen dan sisanya adalah oksigen. Jika diketahui Ar.C = 12, Ar.H = 1,
dan Ar.O = 16. Maka tentukan rumus molekul senyawa ini?
Jawab
Jadi rumus empiris senyawa tersebut adalah CH2O
Dari rumus molekul yang telah diperoleh maka rumus molekul dapat ditentukan sbagai berikut
CH2O)n
(Ar C x n) + (2.Ar H x n) + (Ar.O) = Mr senyawa
12n + 2n + 16n = 180
30n = 180
n=6
jadi rumus molekulnya adalah C6H12O6.
Menentukan Rumus Empiris dan Rumus Molekul Berdasarkan Ar dan Mr
Tentukan rumus molekul yang dimiliki senyawa dengan umus empiris CH, jika
diketahui Mr senyawa tersebut adalah 78?
Jawab
Mr senyawa = (CH)n
78 = (12 + 1)n
78 = 13n
n=6
jadi rumus molekul yang dimiliki senyawa tersebut adalah (CH)n = C6H6.
Anda mungkin juga menyukai
- Ikatan KimiaDokumen32 halamanIkatan KimiaFertin Julian Hotniel GultomBelum ada peringkat
- 6 - Rev. StoichiometriDokumen22 halaman6 - Rev. Stoichiometristifar S1A016100% (1)
- Laporan Resmi Reaksi - Reaksi KimiaDokumen21 halamanLaporan Resmi Reaksi - Reaksi KimiaDanny Adi KurniawanBelum ada peringkat
- LKM 1 - Kelompok 1 - Bio D 2020Dokumen5 halamanLKM 1 - Kelompok 1 - Bio D 2020Nicole de BellBelum ada peringkat
- Makalah Kimia DasarDokumen10 halamanMakalah Kimia DasarGalih Lifee0% (1)
- Reaksi Reaksi Kimia Di AtmosferDokumen14 halamanReaksi Reaksi Kimia Di AtmosferErlina Septiani PutriBelum ada peringkat
- Zoo VerDokumen3 halamanZoo VerMarisa Tri NandaBelum ada peringkat
- Rapid Test SalmonellaDokumen3 halamanRapid Test SalmonellaGiveny GraceBelum ada peringkat
- Isomer GeometriDokumen29 halamanIsomer GeometriFera FajrinBelum ada peringkat
- Laporan Praktikum Kimia DasarDokumen35 halamanLaporan Praktikum Kimia DasarSilky Amanda YuniarBelum ada peringkat
- Tugas 1Dokumen2 halamanTugas 1Natasya Romauli SilitongaBelum ada peringkat
- Kimia KOORDINASIDokumen18 halamanKimia KOORDINASIRizal SuhardimanBelum ada peringkat
- Praktikum KimiaDokumen13 halamanPraktikum KimiaPulung Widi HandokoBelum ada peringkat
- LKM Ikatan Kimia (P-5) - 1Dokumen13 halamanLKM Ikatan Kimia (P-5) - 1Achmad indraBelum ada peringkat
- Teknik Blotting DNA, RNA Dan ProteinDokumen9 halamanTeknik Blotting DNA, RNA Dan ProteinOvi PrudentaBelum ada peringkat
- Kimia Kelompok 2Dokumen5 halamanKimia Kelompok 2GilangBelum ada peringkat
- Bentuk MolekulDokumen25 halamanBentuk MolekulNovianaDewiBelum ada peringkat
- Ayunan KonisDokumen15 halamanAyunan KonisRenaldiBelum ada peringkat
- Reaksi Kimia'Dokumen7 halamanReaksi Kimia'fazwan hafisBelum ada peringkat
- Struktur Dan Fungsi Protein AuliaDokumen8 halamanStruktur Dan Fungsi Protein AuliaAulia NurlatifahBelum ada peringkat
- Praktikum 1 Bentuk MolekulDokumen20 halamanPraktikum 1 Bentuk MolekulWasthiiBelum ada peringkat
- Kimia 1Dokumen9 halamanKimia 1Nadina officialBelum ada peringkat
- Geometri Bentuk MolekulDokumen11 halamanGeometri Bentuk MolekulRizky TricahyaBelum ada peringkat
- KF Gas Tidak IdealDokumen4 halamanKF Gas Tidak IdealArdhiaPramestiRigitaBelum ada peringkat
- Sejarah Penemuan HibridisasiDokumen12 halamanSejarah Penemuan HibridisasiIbnu DarmawantoBelum ada peringkat
- LaporanDokumen15 halamanLaporanRafli FirmanBelum ada peringkat
- Ciri Tanaman BuncisDokumen3 halamanCiri Tanaman BuncisIik MissUnetBelum ada peringkat
- KSP Ketik FixDokumen22 halamanKSP Ketik Fixodie fakhrin rizaldiBelum ada peringkat
- Kel 9 - Laporan Prak Bioumum FotosintesisDokumen11 halamanKel 9 - Laporan Prak Bioumum FotosintesisRahmah Khairunnisa QonitaBelum ada peringkat
- Cara Pembuatan Asam Organik Asam AsetatDokumen3 halamanCara Pembuatan Asam Organik Asam AsetatFarel OfdmBelum ada peringkat
- Tugas Matematika Dasar FarmasiDokumen2 halamanTugas Matematika Dasar FarmasiPharmacist A0% (2)
- Kimia Dasar-Pertemuan 13 - HidrokarbonDokumen6 halamanKimia Dasar-Pertemuan 13 - HidrokarbonAnnisa Septianti IIBelum ada peringkat
- Hukum Dasar KimiaDokumen3 halamanHukum Dasar KimiaWINDABelum ada peringkat
- Soal Ikatan KimiaDokumen6 halamanSoal Ikatan KimiaYolanda Nda AdindaBelum ada peringkat
- Tugas KimiaDokumen5 halamanTugas KimiaZih WildanBelum ada peringkat
- Variabilitas Di Antara IndividuDokumen24 halamanVariabilitas Di Antara IndividuIndah YuliyandiniBelum ada peringkat
- Disusun Untuk Memenuhi Persyaratan Calon Senator DMF MIPA UMDokumen10 halamanDisusun Untuk Memenuhi Persyaratan Calon Senator DMF MIPA UMFitria Lafifa D'zNeba ScouTzBelum ada peringkat
- AsamDokumen9 halamanAsamAris MBelum ada peringkat
- Sejarah Penemuan FotosintesisDokumen12 halamanSejarah Penemuan FotosintesisnishiuraholicBelum ada peringkat
- CIRI CIRI PROTISTA (Morfologi, Fisiologi, Anatomi)Dokumen7 halamanCIRI CIRI PROTISTA (Morfologi, Fisiologi, Anatomi)Resti E KusumaBelum ada peringkat
- 7.2 Fluida StatisDokumen6 halaman7.2 Fluida StatisRafli Ktm720Belum ada peringkat
- Penelitianku 2006 Perbedaan Nilai Gravitasi Bumi&bulanDokumen12 halamanPenelitianku 2006 Perbedaan Nilai Gravitasi Bumi&bulantri ulfa ameldaBelum ada peringkat
- Struktur LewisDokumen4 halamanStruktur LewisArdiansyah YayanBelum ada peringkat
- Laporan Pencemaran UdaraDokumen21 halamanLaporan Pencemaran Udarajanu hidayatBelum ada peringkat
- Soal Soal KoloidDokumen2 halamanSoal Soal KoloidUjang AsjenBelum ada peringkat
- Lambang Berbahaya Lab FisDokumen2 halamanLambang Berbahaya Lab FisJennifer EvangelineBelum ada peringkat
- Jangka SorongDokumen1 halamanJangka SorongM Yudi SuhendarBelum ada peringkat
- Bagian Bagian SelDokumen8 halamanBagian Bagian SelIbaz JuangsihBelum ada peringkat
- Laporan Lengkap Praktikum Biologi - Ibnu Chairulsyah Malotes - G70121010Dokumen69 halamanLaporan Lengkap Praktikum Biologi - Ibnu Chairulsyah Malotes - G70121010Ardi yefta SosoBelum ada peringkat
- Sifat Logam TransisiDokumen6 halamanSifat Logam TransisiMuhammad Wahyudin0% (1)
- Laporan Praktikum Termodinamika KimiaDokumen15 halamanLaporan Praktikum Termodinamika KimiaAgeliya Dwi PratiwiBelum ada peringkat
- Bioteknolgi Teknologi PlasmidDokumen12 halamanBioteknolgi Teknologi PlasmidRatu AsyfaBelum ada peringkat
- Karbohidrat, Protein, LemakDokumen12 halamanKarbohidrat, Protein, LemakDarman RangkutiBelum ada peringkat
- Chapt03 en IdDokumen40 halamanChapt03 en IdEdi SuharmonoBelum ada peringkat
- Soal-Soal Latihan Struktur MolekulDokumen2 halamanSoal-Soal Latihan Struktur MolekulLucielBelum ada peringkat
- Juni Harlin Anggraini - F1C420015 - Kelompok Ii - Laporan Akhir Praktikum Kimia Dasar 5Dokumen36 halamanJuni Harlin Anggraini - F1C420015 - Kelompok Ii - Laporan Akhir Praktikum Kimia Dasar 5chanyeol exo-L100% (1)
- KIMIA DASAR Matrikulasi RMPDokumen2 halamanKIMIA DASAR Matrikulasi RMPGhifahriBelum ada peringkat
- Rumus EmpirisDokumen20 halamanRumus EmpirisribasdBelum ada peringkat
- Rumus KimiaDokumen24 halamanRumus KimiaHalimah AzzahraBelum ada peringkat
- Rumus EmpirisDokumen45 halamanRumus EmpirisAde Ilham Khaled100% (1)
- ADokumen5 halamanAst nurdia hasmaBelum ada peringkat
- Dapus KimfisDokumen2 halamanDapus Kimfisst nurdia hasmaBelum ada peringkat
- Iodo FixxxxxxxDokumen4 halamanIodo Fixxxxxxxst nurdia hasmaBelum ada peringkat
- Fasa Cair Nunu KimfisDokumen6 halamanFasa Cair Nunu Kimfisst nurdia hasmaBelum ada peringkat
- GrafikDokumen1 halamanGrafikst nurdia hasmaBelum ada peringkat
- Bingkai Kli (PinfDokumen1 halamanBingkai Kli (Pinfst nurdia hasmaBelum ada peringkat
- Peta Konsep KepustakaanDokumen3 halamanPeta Konsep Kepustakaanst nurdia hasmaBelum ada peringkat
- Contoh Artikel Perdagangan Internasional Di IndonesiaDokumen9 halamanContoh Artikel Perdagangan Internasional Di Indonesiast nurdia hasma0% (2)
- MSDS Unit 6 AnalitikDokumen13 halamanMSDS Unit 6 Analitikst nurdia hasmaBelum ada peringkat
- MSDS Unit 2 AnalitikDokumen28 halamanMSDS Unit 2 Analitikst nurdia hasmaBelum ada peringkat
- Unit 6 Kimia Fisik MRDokumen16 halamanUnit 6 Kimia Fisik MRst nurdia hasmaBelum ada peringkat
- DOKUMENTAS1 Asam AminoDokumen3 halamanDOKUMENTAS1 Asam Aminost nurdia hasmaBelum ada peringkat
- JummmmmDokumen2 halamanJummmmmst nurdia hasmaBelum ada peringkat
- Bundelan OrganikDokumen2 halamanBundelan Organikst nurdia hasmaBelum ada peringkat
- Latar BelakangDokumen19 halamanLatar Belakangst nurdia hasmaBelum ada peringkat
- Prodesur KerjaDokumen2 halamanProdesur Kerjast nurdia hasmaBelum ada peringkat
- Adapun Reaksi Yang Seharusnya Terjadi Adalah Sebagai BerikutDokumen2 halamanAdapun Reaksi Yang Seharusnya Terjadi Adalah Sebagai Berikutst nurdia hasmaBelum ada peringkat
- Isomer KerangkaDokumen1 halamanIsomer Kerangkast nurdia hasma100% (1)
- Dapus KimfisDokumen2 halamanDapus Kimfisst nurdia hasmaBelum ada peringkat
- Asam Amino Merupakan Satuan Penyusun ProteinDokumen5 halamanAsam Amino Merupakan Satuan Penyusun Proteinst nurdia hasmaBelum ada peringkat
- MPAK PendahuluanDokumen29 halamanMPAK PendahuluanEka Yana Putri YaniBelum ada peringkat
- Prodesur KerjaDokumen2 halamanProdesur Kerjast nurdia hasmaBelum ada peringkat
- Pembuatan WarnaDokumen9 halamanPembuatan Warnast nurdia hasmaBelum ada peringkat
- Adapun Reaksi Yang Seharusnya Terjadi Adalah Sebagai BerikutDokumen2 halamanAdapun Reaksi Yang Seharusnya Terjadi Adalah Sebagai Berikutst nurdia hasmaBelum ada peringkat
- Sampul BundelanDokumen1 halamanSampul Bundelanst nurdia hasmaBelum ada peringkat
- Belajar EfektifDokumen8 halamanBelajar Efektiflia arianiBelum ada peringkat
- Makalah Review BukuDokumen7 halamanMakalah Review Bukust nurdia hasma0% (1)
- Anor KLP 6Dokumen2 halamanAnor KLP 6st nurdia hasmaBelum ada peringkat
- Bundelan Biokimia EmpeduDokumen14 halamanBundelan Biokimia Empedust nurdia hasmaBelum ada peringkat
- TINGKAT KERENTANAN Fasciola Gigantica PADA SAPI DAN KERBAU DI KECAMATAN LHOONG KABUPATEN ACEH BESAR PDFDokumen5 halamanTINGKAT KERENTANAN Fasciola Gigantica PADA SAPI DAN KERBAU DI KECAMATAN LHOONG KABUPATEN ACEH BESAR PDFEnnur NufianBelum ada peringkat