P Mikrobiologi - Acara 4 - Identifikasi Bakteri - Morfologi Koloni Dan Morfologi Sel
Diunggah oleh
Prasetyo Hendy KurniawanHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
P Mikrobiologi - Acara 4 - Identifikasi Bakteri - Morfologi Koloni Dan Morfologi Sel
Diunggah oleh
Prasetyo Hendy KurniawanHak Cipta:
Format Tersedia
ACARA IV IDENTIFIKASI BAKTERI : UJI MORFOLOGI KOLONI DAN MORFOLOGI SEL
A. TUJUAN 1. MORFOLOGI KOLONI Mengidentifikasi bermacam-macam bentuk morfologi koloni bakteri yang tumbuh dalam bermacam-macam media berdasarkan konsistensi media pertumbuhannya
2. MORFOLOGI SEL
Mengidentifikasi karakter morfologi sel individual yang meliputi : ada tidaknya flagela (sifat motilitas), bentuk dan rangkaian sel, ada tidaknya spora dan reaksi-reaksi sel bakteri terhadap pengecatan (sifat Gram dan acid fast) a. Gerakan bakteri Untuk melihat pergerakan bakteri di bawah mikroskop maupun pada media pertumbuhan b. Pengecatan bakteri Untuk mempelajari jenis-jenis pengecatan bakteri dan melihat bentuk sel, rangkaian sel, sifat gram (gram negatif dan gram positif), sifat tahan asam (acid fast dan non acid fast) dan ada tidaknya spora.
B. DASAR TEORI Bakteri merupakan mikrobia uniseluler yang termasuk dalam kelas Shizomycetes. Pada umumnya bakteri tersebar luas di alam. Ada yang hidup
bebas, bersifat saprofitik, parasit atau patogen pada manusia, binatang atau tumbuhan. Ada beberapa jenis bakteri yang bersifat fotosintetik. Ada tiga bentuk dasar bakteri yaitu bentuk bulat (coccus), batang (bacillus), dan melilit (spiral) (Irianto, 2007). Mikroorganisme merupakan jasad berukuran mikroskopis yang beraneka ragam bentuk dan jenisnya, punya sejumlah ciri yang perlu dipahami untuk mengadakan klasifikasi dan identifikasi. Ciri pokok mikroorganisme dapat dibedakan dalam beberapa kategori yaitu ciri morfologi, kultural, susunan kimia, metabolik, anigenik, patogenitas, dan ciri ekologis. Ciri-ciri mikroorganisme meliputi banyak hal yaitu, ukuran, struktur, pengatur sel, bentuk perkembangan, reaksi terhadap cat, motilitas, dan susunan flagella. Berbeda dengan ciri determinasi mengenai ciri morfologi ini butuh pemahaman tentang sel-sel individu dalam suatu kultur murni. Tubuh mikroorganisme sangat kecil dan ukurannya bisa dinyatakan dengan mikrometer. Suatu mikrometer sama dengan 0,001 mm atau kira-kira 0,0004 inch (Tarigan, 1988). Pengecatan adalah pewarnaan mikroba-mikroba dengan suatu cat (dye) yang mengutamakan struktur tertentu saja, misalnya bagian-bagian sel. Mikroorganisme sulit dilihat dengan mikroskop cahaya, karena tidak mengabsorbsi atau membiaskan cahay (Tarigan, 1988). Dalam mikrobiologi, dikenal beberapa cara pengecatan, yaitu : 1. Pengecatan sederhana (simple staining) Hanya menggunakan 1 macam zat warna untuk meningkatkan kontras antar mikroorganisme dan sekelilingnya. Zat warna yang biasanya digunakan zat warna basa seperti kristal violet, biru metylen, karbol fuksin basa, safranin atau hijau malakit, kadang digunakan juga zat warna negatiev dan zat warna asa,. Pewarnaan ini sering digunakan untuk melihat bentuk, ukuran, penataan mikroorganisme. 2. Pengecatan differensial (differential staining)
Pengematana jelas tentang perbedaan antara sel bakteri / bagian sel bakteri. Bertujuan untuk mengetahui bagian-bagian sel bakteri terhadap cat dan mengetahui bagian-bagian sel bakteri yang tidak dapat diamati dengan pengecatan sederhana (Tarigan, 1988).
Mikrobia tidak punya ciri anatomi yang jelas, sehingga identifikasi bakteri didasarkan pada morfologi, sifat biakkan, dan sifat biokimia. Mikroorganise yang akan diisolasi dapat berupa biakan murni atau populasi campuran. Bila biakan tercemar, dilakukan pemurnian terlebih dahulu. Setelah didapat biakan murni dapat dilakukan serangkaian uji untuk memperoleh ciri morfologi dan biokimia isolat. Setiap uji yang dilakukan harus menggunakan kontrol untuk mengetahui apakah media serta reagens yang digunakan benar dan tepat. Rujukan yang dipakai dalam identifikasi adalah Bergeys Manual of Systematic Bacteriology yang didasarkan pada morfologi, sifat faali, dan sifat biokimia bakteri (Lay, 1994).
C. PROSEDUR KERJA 1. MORFOLOGI KOLONI
a. Morfologi Koloni Bakteri dalam Media Cair
Alat dan Bahan Media nutrien cair (NB) dalam tabung reaksi Jarum ose Isolat murni bakteri tanah sludge (hasil percobaan Acara III)
Skema Kerja
Siapkan media nutrien cair (NB) yang telah disterilkan. Inokulasikan secara aseptik biakan murni isolat bakteri tanah sludge dengan menggunakan ose (1-2 ose) pada media NB. Inkubasikan pada suhu kamar selama 24-48 jam. Amati pertumbuhan biakan bakteri pada permukaan media, kekeruhan, bau dan ada tidaknya endapan. Bandingkan dengan kontrol (media tanpa inokulasi bakteri). Perhatian : pada saat pengamatan, dilarang melakukan penggojogan tabung! Tentukan karakter bakteri tersebut berdasarkan kebutuhannya akan O2 (aerob, fakultatif anaerob, anaerob).
b. Morfologi Koloni Bakteri dalam Media Agar Tegak
Alat dan Bahan Media NA tegak dalam tabung reaksi Jarum inokulasi Isolat murni bakteri tanah sludge (hasil percobaan Acara III)
Skema Kerja Siapkan medium NA tegak steril. Inokulasikan secara aseptik biakan murni isolat bakteri tanah sludge dengan menggunakanjarum inokulasi secara tusukan sampai ke dalam tabung. Perhatikan : penanaman secara tusukan tidak boleh sampai dasar tabung! Inkubasikan pada suhu kamar selama 24- 48 jam. Amati pertumbuhannya, merata atau tidak, pertumbuhannya baik pada bagian permukaan atau bagian dasar, bagaimana bentuk pertumbuhan pada bekas tusukan (filiform, echinulate, beaded, villous, rhizoid, arborescent) (lihat Jutono dkk., 1980 atau lihat alat peraga di laboratorium!). Bandingkan dengan kontrol (media tanpa inokulasi bakteri).
c. Morfologi Koloni Bakteri dalam Media Agar Miring
Alat dan Bahan Media NA miring dalam tabung reaksi Jarum ose / Jarum inokulasi Isolat murni bakteri tanah sludge (hasil percobaan Acara III)
Skema Kerja Media NA miring steril diinokulasi secara aseptik dengan dengan biakan murni isolat bakteri tanah sludge menggunakan ose/jarum inokulasi secara goresan lurus. Inkubasi pada suhu kamar selama 24-48 jam. Amati pertumbuhan : tipis, sedang, lebat atau tidak ada, bentuk pertumbuhan pada goresan (filiform, echinulate, beaded, spreading, arborescent, rhizoid, plumose), elevasi, kilat, topografi, warna, bau, dan konsistensinya (lihat Jutono dkk., 1980 atau lihat alat peraga di laboratorium!). Bandingkan dengan kontrol (media tanpa inokulasi bakteri).
d. Morfologi Bakteri dalam Media Cawan Agar
Alat dan Bahan Jarum ose Media NA dalam petri (cawan agar) Isolat munri bakteri tanah sludge (hasil percobaan Acara III)
Skema Kerja
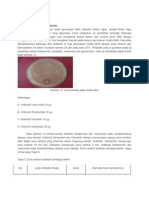
Inokulasikan secara aseptik 1 ose biakan murni isolat bakteri tanah sludge ke dalam cawan agar secara streak plate. Perhatikan jalur dan arah goresan! (lihat kembali Acara II.4c). Inkubasikan secara terbalik pada suhu kamar selama 24-48 jam. Perhatikan dan amati koloni-koloni terpisah yang terbentuk. Amati pertumbuhan : pertumbuhan koloni di permukaan atau di bawah permukaan media, bentuk koloni, permukaan koloni, elevasi, bentuk tepi dan bentuk struktur dalam (lihat Jutono dkk., 1980 atau lihat alat peraga di laboratorium!). Bandingkan dengan kontrol (media tanpa inokulasi bakteri).
2. MORFOLOGI SEL
a. Gerakan Bakteri
(1) Gerakan Bakteri dengan Metode Tetes Gantung / Hanging Drop Alat dan Bahan
Mikroskop cahaya
Gelas benda cekung dan gelas penutup Tusuk gigi Vaselin Isolat murni bakteri tanah sludge (hasil percobaan Acara III)
Skema Kerja Dengan menggunakan tusuk gigi, tempatkanlah 4 gumpalan vaselin pada ujung-ujung gelas penutup. Letakkan 1 ose isolat murni bakteri tanah sludge pada gelas penutup (jika media padat,tambahkan kultur dengan air). Kemudian tempelkan gelas penutup bervaselin pada gelas benda cekung. Pastikan bahwa kultur isolat yang akan diamati tepat berada di bagian yang cekung dari gelas benda. Balikkan gelas penutup pada gelas benda dengan hati-hati sedemikian sehingga ujung-ujung vaselin pada gelas benda berlekatan dengan baik pada gelas penutup. Amati dengan perbesaran lemah/kuat ada tidaknya gerakan bakteri (hati-hati dengan adanya gerakan "brownian"
(2) Gerakan Bakteri dengan Cara Tusukan Alat dan Bahan Media semisolid dengan kandungan agar 0,20,4 % Jarum inokulasi Isolat murni bakteri tanah sludge (hasil percobaan Acara III)
Skema Kerja Inokulasikan isolat murni bakteri tanah sludge pada media semi solid (0,2-0,4% agar) steril dengan menggunakan jarum inokulasi secara tusukan. Inkubasikan pada temperatur kamar selama 24-48 jam. Amati hasil pertumbuhan dan gambarkan. Amati ada tidaknya gerakan bakteri.
b. Pengecatan-Pengecatan Bakteri
(1) Pengecatan Gram
Alat dan Bahan Mikroskop cahaya Crystal violet (Gram A) Larutan iodine (Gram B) Alkohol 96% (Gram C) Safranin (Gram D) Minyak immersi Isolat murni bakteri tanah sludge (hasil percobaan Acara III)
Gelas benda Jarum ose
Skema Kerja Buatlah pulasan bakteri di atas objek gelas, keringkan dan fiksasi dengan api (lihat kembali Acara I). Teteskan cat crystal violet (Gram A) dan diamkan 30-60 detik. Buanglah sisa cat dan cuci sisanya dengan air mengalir. Teteskan larutan iodine (Gram B) dan diamkan selama 1-2 menit. Cuci dengan air mengalir, kemudian di decolorisasi (di beri larutan peluntur) dengan alkohol (Gram C) (kira-kira 20 detik, hati-hati jangan sampai berlebihan yang mengakibatkan kesalahan hasil). Cuci dengan air mengalir, tambahkan larutan safranin (Gram D) selama 10-20 detik. Cuci kembali dengan air mengalir, angin-anginkan dan amati di bawah mikroskop dengan perbesaran kuat (1000x) menggunakan minyak immersi.
Gambar hasil-hasil pengecatan bakteri dengan diberi keterangan mengenai warna sel bakteri yang menunjukkan sifat gram dan bentuk sel.
(2) Pengecatan Acid Fast (Ziehl Neelsen) Alat dan Bahan Gelas objek Mikroskop Cat ziehl Neelsen carbolfuchsin (ZN A) Peluntur (Alkohol 96%) (ZN B) Metylen blue (ZN C) Isolat murni bakteri tanah sludge (hasil percobaan Acara III)
Skema Kerja Buatlan pulasan bakteri, dan fiksasi di atas bunsen. Tutupkan dengan sepotong kertas filter, tambahkan larutan carbolfuchsin (ZN A), panaskan di atas bunsen dengan nyala kecil (hati-hati!), diamkan selama 5-10 menit. Dinginkan, cuci dengan air mengalir dan angin-anginkan.
Cuci dengan larutan peluntur alkohol 96% (ZN B) sambil digoyanggoyangkan sampai seluruh pulasan tak nampak. Cuci dengan air mengalir, keringkan. Bubuhkan dengan cat penutup metylen biru (ZN C) selama 20-30 detik. Cuci, keringkan dan amati dengan perbesaran kuat (1000x) menggunakan minyak immersi. Gambar hasil-hasil pengamatan. Beri keterangan mengenai bentuk sel, warna dan reaksi pengecatan.
(3) Pengecatan Spora
Alat dan Bahan Malachitte green 5% Safranin Mikroskop Minyak immersi Isolat murni bakteri tanah sludge (hasil percobaan Acara III)
Gelas benda Jarum ose
Skema Kerja Pengecatan Spora metode Schaefler dan Fulton Buatlah pulasan bakteri dan fiksasi di atas bunsen (Acara I). Tetesi dengan Malachite green berlebihan dan biarkan selama 1 menit. Panasi dengan cara melalukannya di atas nyala lampu bunsen sampai menguap selama menit. Cuci dengan air mengalir selama menit dan keringanginkan. Tambahkan cat safranin selama 5 menit. Cuci, keringanginkan dan amati dengan mikroskop perbesaran kuat (1000x) dengan minyak imersi. Gambar hasil-hasil pengamatan : bentuk sel dan letak spora (sentral, terminal atau sub terminal)
Skema Kerja Pengecatan Spora metode Bartholomew dan Mittwer Buatlah pulasan bakteri dan fiksasi di atas bunsen (Acara I).
Tetesi dengan Malachite green selama 10 menit (jangan dipanasi!). Cuci dengan air mengalir selama 10 detik dan keringanginkan. Tambahkan cat safranin selama 5-10 detik. Cuci dan amati dengan mikroskop perbesaran kuat (1000x). Gambar hasil-hasil pengamatan : bentuk sel dan letak spora (sentral, terminal atau sub terminal)
Anda mungkin juga menyukai
- LHP 4 (Tasya Triana Putri - 1900017059)Dokumen3 halamanLHP 4 (Tasya Triana Putri - 1900017059)Tasya Triana PutriBelum ada peringkat
- Tugas Farmakologi Unpri by DianDokumen9 halamanTugas Farmakologi Unpri by DianDian AkbariBelum ada peringkat
- Media BakteriDokumen7 halamanMedia BakteriJohanes Tanner100% (1)
- Diskusi 1 ImunologiDokumen2 halamanDiskusi 1 ImunologiRirin Karina0% (1)
- Kelompok 3 - Tabel Ringkasan Virus Limfatik Dan KardiovaskularDokumen12 halamanKelompok 3 - Tabel Ringkasan Virus Limfatik Dan KardiovaskularDini Maulidina50% (2)
- BegoniaDokumen20 halamanBegoniaLeicneagra LeicBelum ada peringkat
- FILE 3 KemoterapetikaDokumen24 halamanFILE 3 KemoterapetikaRenno BramantioBelum ada peringkat
- Mikrobiologi DLM Bidang FarmasiDokumen16 halamanMikrobiologi DLM Bidang FarmasiPutridewicaBelum ada peringkat
- Pewarnaan SederhanaDokumen8 halamanPewarnaan SederhanaRosarida PurbaBelum ada peringkat
- Pengertian AntibiotikDokumen4 halamanPengertian AntibiotikAnonymous EWoYvEBelum ada peringkat
- Klasifikasi FungiDokumen25 halamanKlasifikasi FungiMandala MeaBelum ada peringkat
- Pengendalian MikroorganismeDokumen36 halamanPengendalian MikroorganismeAnn JanicelyBelum ada peringkat
- Lipid RevisiDokumen35 halamanLipid Revisiaserda werdBelum ada peringkat
- Makalah Jaringan Tumbuhan Tingkat TinggiDokumen17 halamanMakalah Jaringan Tumbuhan Tingkat TinggiRenAria6918Belum ada peringkat
- MIKROBIOLOGI FARMASI Fungi, Alga, Lichen, Dan ProtozoaDokumen38 halamanMIKROBIOLOGI FARMASI Fungi, Alga, Lichen, Dan Protozoa70311175% (4)
- Lks Analisis MikrobiologiDokumen22 halamanLks Analisis MikrobiologiAmbarini Roro NingtyasBelum ada peringkat
- Mikrobiologi d1 p5 LR 208114171Dokumen34 halamanMikrobiologi d1 p5 LR 208114171Rafael ErlanggaBelum ada peringkat
- MIKROBIOLOGI PAK SYAMMDokumen38 halamanMIKROBIOLOGI PAK SYAMMArlinnusiBelum ada peringkat
- Dasar BakteriologiDokumen38 halamanDasar BakteriologiMaharRkpBelum ada peringkat
- Mekanisme PatogenesisDokumen13 halamanMekanisme PatogenesisTrisnanurmalasari100% (1)
- Makalah Mikrobiologi (Bahan Alam)Dokumen21 halamanMakalah Mikrobiologi (Bahan Alam)Rezky MulyaniBelum ada peringkat
- Insufisiensi AdrenokortikalDokumen3 halamanInsufisiensi AdrenokortikalAnnisa Shafira NadyaBelum ada peringkat
- Kelompok 4 - Rekayasa Genetika HormonDokumen19 halamanKelompok 4 - Rekayasa Genetika HormonMaskur AbdulBelum ada peringkat
- Pseudomonas SPDokumen17 halamanPseudomonas SPVálentiná KrásnýBelum ada peringkat
- Bentuk Susunan Dan Sifat Media Part 2Dokumen3 halamanBentuk Susunan Dan Sifat Media Part 2Resty OktariyaniBelum ada peringkat
- Siti Mashita Caopana-A 171 046-Sejarah Penemuan Dan Kegunaan Asam SalisilatDokumen2 halamanSiti Mashita Caopana-A 171 046-Sejarah Penemuan Dan Kegunaan Asam SalisilatSiti Mashita CaopanaBelum ada peringkat
- Taksonomi MikrobiologiDokumen4 halamanTaksonomi MikrobiologiJean Julianto SamuelBelum ada peringkat
- Resistensi BakteriDokumen17 halamanResistensi BakteriGina Novi TrianaBelum ada peringkat
- Penetapan Kadar Vitamin C Pada PareDokumen39 halamanPenetapan Kadar Vitamin C Pada PareDeni HamdaniBelum ada peringkat
- Identifikasi Dan Isolasi StaphylococcusDokumen35 halamanIdentifikasi Dan Isolasi StaphylococcusViztha Dwi SetyariniBelum ada peringkat
- Ringkasan Materi AntimikrobaDokumen7 halamanRingkasan Materi AntimikrobaGebby Fransi KahardBelum ada peringkat
- CIPROFLOXACINDokumen33 halamanCIPROFLOXACINArief Aqshal Hadi100% (1)
- Jurnal Identifikasi MikrobaDokumen5 halamanJurnal Identifikasi MikrobaYamaniel Ginting100% (1)
- Makalah Antimikroba Kel 6Dokumen106 halamanMakalah Antimikroba Kel 6Neng'laila AsyaaBelum ada peringkat
- Infeksi Jamur Pada Saluran Cer-1Dokumen13 halamanInfeksi Jamur Pada Saluran Cer-1Puput PujiamaBelum ada peringkat
- Mikrobiologi AlgaDokumen28 halamanMikrobiologi AlgaFebrika Pangesti AdjiBelum ada peringkat
- Pewarnaan GramDokumen10 halamanPewarnaan GramMay Sil Vani100% (1)
- 152210101127Dokumen38 halaman152210101127Anonymous vho9X9IBelum ada peringkat
- CATATAN FarmakologiDokumen5 halamanCATATAN Farmakologidyah caturBelum ada peringkat
- Flora Normal TubuhDokumen9 halamanFlora Normal TubuhCharlina Amelia Br-BarusBelum ada peringkat
- Praktikum Kultivasi Dan IsolasiDokumen6 halamanPraktikum Kultivasi Dan IsolasiAyuKomalannesianaSari100% (1)
- Struktur Sel Beserta Fungsinya Pada Sel Hewan Dan TumbuhanDokumen8 halamanStruktur Sel Beserta Fungsinya Pada Sel Hewan Dan Tumbuhanfadel anshoriBelum ada peringkat
- Karakterisasi Sifat Biokimia Dan Fisiologi BakteriDokumen8 halamanKarakterisasi Sifat Biokimia Dan Fisiologi BakteriAtho SagalaBelum ada peringkat
- Laporan II - Pembuatan Medium 2016 (Wiri Resky Amalia)Dokumen22 halamanLaporan II - Pembuatan Medium 2016 (Wiri Resky Amalia)Wiri Resky AmaliaBelum ada peringkat
- Makalah Bakteriologi 2Dokumen13 halamanMakalah Bakteriologi 2Julia SyabilaBelum ada peringkat
- Pewarnaan Spora Pada BakteriDokumen8 halamanPewarnaan Spora Pada BakteriRatu IoraBelum ada peringkat
- Media MHDokumen5 halamanMedia MHYunita PrabaBelum ada peringkat
- Fragmen 2Dokumen2 halamanFragmen 2Gilang Sumiarsih PramanikBelum ada peringkat
- Formulasi Krim DAUN KAPASDokumen7 halamanFormulasi Krim DAUN KAPASYuli Dwi IstantiBelum ada peringkat
- Bakteri Gram Positif Dan NegatifDokumen1 halamanBakteri Gram Positif Dan NegatifEva Apriliyana RizkiBelum ada peringkat
- Isolasi Dan Identifikasi Mikroorganisme BakteriDokumen13 halamanIsolasi Dan Identifikasi Mikroorganisme BakteriNur'ainBelum ada peringkat
- Clostridium Perfringens NewDokumen13 halamanClostridium Perfringens NewAngela NovitaBelum ada peringkat
- SOAL FARMA Bu ElzyeDokumen80 halamanSOAL FARMA Bu ElzyefebrianBelum ada peringkat
- Power Point Bakteri Yang MenguntungkanDokumen20 halamanPower Point Bakteri Yang Menguntungkandewi hanifah muazarohBelum ada peringkat
- Laporan Fismed TensimeterDokumen4 halamanLaporan Fismed TensimeterRinto Prio RizaldiBelum ada peringkat
- Laporan Praktikum 4Dokumen15 halamanLaporan Praktikum 4Hindami NugrohoBelum ada peringkat
- Laporan Praktikum MikroDokumen13 halamanLaporan Praktikum MikroSesilia Bernadet Soubirous MarshellaBelum ada peringkat
- Laporan BakteriDokumen15 halamanLaporan BakteriSiti WahyuniBelum ada peringkat
- Praktikum Mikrobiologi UmumDokumen80 halamanPraktikum Mikrobiologi UmumFatma AinaBelum ada peringkat
- Laporan Pewarnaan BakteriDokumen16 halamanLaporan Pewarnaan BakteriSt. HajarBelum ada peringkat
- Makalah EpilepsiDokumen35 halamanMakalah EpilepsiPrasetyo Hendy KurniawanBelum ada peringkat
- Chord Anggun MimpiDokumen1 halamanChord Anggun MimpiPrasetyo Hendy KurniawanBelum ada peringkat
- Ost Ghost at School - Lyric CHordDokumen1 halamanOst Ghost at School - Lyric CHordPrasetyo Hendy KurniawanBelum ada peringkat
- Pancasila Nilai-Nilai PancasilaDokumen5 halamanPancasila Nilai-Nilai PancasilaPrasetyo Hendy KurniawanBelum ada peringkat
- Perhitungan Studi Kelayakan ApotekDokumen2 halamanPerhitungan Studi Kelayakan ApotekPrasetyo Hendy KurniawanBelum ada peringkat
- Tugas P.pharcare - Laminar Air FlowDokumen3 halamanTugas P.pharcare - Laminar Air FlowPrasetyo Hendy KurniawanBelum ada peringkat
- Contoh Surat RekomendasiDokumen1 halamanContoh Surat RekomendasiPrasetyo Hendy KurniawanBelum ada peringkat
- Terapi AntidotumDokumen13 halamanTerapi AntidotumPrasetyo Hendy Kurniawan100% (1)
- Purification and Characterization of Extracellular α-AmilaseDokumen28 halamanPurification and Characterization of Extracellular α-AmilasePrasetyo Hendy KurniawanBelum ada peringkat
- Cara Menghitung Harga Jual Obat Di APOTEKDokumen2 halamanCara Menghitung Harga Jual Obat Di APOTEKNengahWidya79% (24)
- Farfis - Sifat Alir CairanDokumen5 halamanFarfis - Sifat Alir CairanPrasetyo Hendy Kurniawan50% (2)
- Laporan Keuangan ApotekDokumen2 halamanLaporan Keuangan ApotekPrasetyo Hendy Kurniawan100% (3)
- Uji Ketoksikan SubkronisDokumen13 halamanUji Ketoksikan SubkronisPrasetyo Hendy Kurniawan100% (3)
- Farmakognosi Fitokimia Uji AntioksidanDokumen4 halamanFarmakognosi Fitokimia Uji AntioksidanPrasetyo Hendy Kurniawan100% (1)
- Kulit Buah DelimaDokumen2 halamanKulit Buah DelimaPrasetyo Hendy KurniawanBelum ada peringkat
- Farfis - ViskositasDokumen6 halamanFarfis - ViskositasPrasetyo Hendy KurniawanBelum ada peringkat
- P Mikrobiologi Acara 5 Identifikasi Dan Determinasi Bakteri - Uji BiokimiawiDokumen12 halamanP Mikrobiologi Acara 5 Identifikasi Dan Determinasi Bakteri - Uji BiokimiawiPrasetyo Hendy Kurniawan75% (4)
- P Mikrobiologi - Acara 8 - Uji Cemaran Mikroba Angka Lempeng Total (ALT) Dan Angka Kapang Khamir (AKK)Dokumen15 halamanP Mikrobiologi - Acara 8 - Uji Cemaran Mikroba Angka Lempeng Total (ALT) Dan Angka Kapang Khamir (AKK)Prasetyo Hendy Kurniawan75% (8)
- Pembahasan Identifikasi Dan Determinasi Bakteri Uji BiokimiaDokumen4 halamanPembahasan Identifikasi Dan Determinasi Bakteri Uji BiokimiaPrasetyo Hendy KurniawanBelum ada peringkat
- Farfis Acara 1 Penentuan Bobot Jenis Dan KerapatanDokumen4 halamanFarfis Acara 1 Penentuan Bobot Jenis Dan KerapatanPrasetyo Hendy KurniawanBelum ada peringkat
- Mekanisme Reaksi Etil AsetatDokumen2 halamanMekanisme Reaksi Etil AsetatPrasetyo Hendy KurniawanBelum ada peringkat