Tugas SPH 2 - Pembahasan
Diunggah oleh
Karina Nur'aini0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
40 tayangan7 halamanJudul Asli
Tugas SPH 2 - Pembahasan (3)
Hak Cipta
© © All Rights Reserved
Format Tersedia
DOCX, PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
40 tayangan7 halamanTugas SPH 2 - Pembahasan
Diunggah oleh
Karina Nur'ainiHak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 7
BAB II
PEMBAHASAN
2.1. Tipe Telur
Manusia merupakan salah satu spesies mamalia lebih tepatnya eutherian
mammals, artinya memiliki plasenta. Kelompok tersebut memiliki tipe telur
Alecithal, yaitu ketika yolk berjumlah sedikit atau bahkan tidak ada (Zhang, 2009)
dengan persebaran merata pada seluruh sitoplasma ovum (tipe Isolesital)
(Milachich, 2014).
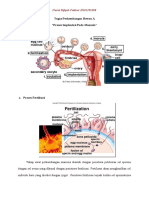
2.2. Fertilisasi
Perkembangan embrio mamalia didahului dengan fertilisasi yang terjadi secara
internal, yaitu proses fertilisasi terjadi di dalam organ reproduksi wanita. Secara
umum tahapan fertilisasi meliputi: (1) kontak dan pengenalan antara sperma
dengan ovum, (2) regulasi masuknya satu sperma ke dalam ovum, (3) fusi materi
genetik sel sperma dan sel ovum, serta (4) aktivasi metabolsime sel telur (Harris
and Johnson, 2006).
Sel sperma yang telah diejakulasikan harus melewati tahap pematangan
fisiologi terlebih dahulu yang disebut dengan kapasitasi yang memungkinkan
timbulnya reaksi akrosom. Proses ini berlangsung selama 5-7 jam dan terjadi di
bagian uterus serta oviduk yang difasilitasi oleh cairan pada saluran reproduksi
wanita. Tahap kapasitasi terdiri dari: peningkatan konsentrasi Ca2+, peningkatan
motilitas spermatozoa dan hilangnya antigen pada permukaan spermatozoa
sehingga memungkinkan spermatozoa untuk lebih reseptif terhadap pengikatan sel
telur.
Gambar 2. Kapasitas spermatozoa sebelum melakukan fertilisasi
Kontak dan pengenalan sperma diawali dengan terikatnya protein membran
spermatozoa pada reseptor ZP3 yang terdapat pada zona pelusida sel telur. ZP
merupakan glikoprotein, yaitu polipeptida yang berikatan dengan molekul gula
yang berbeda-beda, terdiri dari komplek oligosakarida asparagine (N-linked) dan
serin atau threonin (O-linked) (Bessonnard, 2015). Glikoprotein ZP3 mempunyai
peranan sebagai reseptor spermatozoa dengan membentuk ikatan komplemen pada
membrane kepala spermatozoa. Ikatan tersebut merupakan ikatan primer
irreversibel antara sel telur dengan spermatozoa. Setelah spermatozoa terikat
dengan zona peleusida, proenzim proteolitik (contohnya: enzim hyaluronidase)
digunakan untuk melepaskan ikatan glikoprotein ZP3.
Gambar 3. Tahapan fertilisasi antara spermatozoa dan sel telur
Secara molekuler, terjadinya ikatan primer akan merangsang terbukanya kanal
ion kalsium yang akan menyebabkan konsentrasi kalsium di dalam spermatozoa
meningkat dan memicu eksositosis kandungan akrosom spermatozoa (Sadler,
1996). Dengan adanya reaksi akrosom, akan terbentuk ikatan sekunder antara
protein-protein membran dalam akrosom dengan ZP2 sebelum spermatozoa
menembus zona pelusida. Bagian terluar dari membran plasma akrosome berfusi
pada berbagai tempat dan kandungan akrosome dikeluarkan. Selama reaksi
akrosom berlangsung di zona pelusida, vesikula akrosom akan mengeluarkan
enzim-enzim proteolitik serta enzim-enzim hidrolase yang memungkinkan
spermatozoa menembus zona pelusida dan mencapai membran sel telur. Dua
macam komponen penting dari kandungan akrosome yang dikeluarkan adalah
akrosin (Protease serin) dan Nacetylglucoaminidase. Acrosin akan membuat
lubang di bagian zona pelusida, sehingga seprmatozoa dapat mencapai sel telur.
Sementara, N-acetylglucoaminidase akan menghidrolisis O-linked oligosakarida di
ZPGP III untuk memungkinkan spermatozoa terikat.
Fusi materi genetik dari sperma dengan oosit terjadi setelah protein membran
spermatozoa terikat pada reseptor di vili membran oosit, selanjutnya terjadi
distribusi DNA sperma ke dalam sitoplasma oosit yang berada dalam metafase II
meisosis II. Ca2+ yang masuk bersamaan dengan masuknya materi genetik sperma
menyebabkan aktivasi enzim kinase yang berfungsi dalam proteolysis pada siklin
dan sekurin sehingga siklus sel dilanjutkan dan menghasilkan kromosom yang
haploid dan akan diakhiri dengan terjadinya fusi membran pronuklear kedua
gamet. Meningkatnya Ca2+ dalam sitoplasma sel telur menyebabkan beberapa
dampak seperti aktivasi sel telur untuk meneruskan kembali proses meiosis II,
eksositosis granula korteks dan pembentukan pronukleus. Senyawa penting seperti
fertilin yang terdapat pada membran posterior kepala spermatozoa serta integrin,
protein transmembran, yang dijumpai di permukaan membran plasma sel telur,
kedua terlibat dalam peleburan membran plasma dan sel telur (Dzamba, 2009).
Setelah sebuah sel sperma berhasil berdifusi dengan sel ovum, terjadi suatu
reaksi kortikal yang menyebabkan zona pelusida menjadi keras sehingga mencegah
spermatozoa lain untuk berdifusi dengan membran sel telur. Di dalam mekanisme
cepat, terjadi perubahan ion-ion yang menyebabkan: permeabilitas terhadap Na+
meningkat sehingga terjadi depolarisasi membran yang hanya berlangsung
beberapa detik, terjadinya influks Ca2+ dan enfluks H+ dari defosit intraseluler
menyebabkan perubahan pH. Kejadian-kejadian tersebut membuat sel telur tidak
dapat dipenetrasi kembali oleh spermatozoa yang lain dan akan memicu inisiasi
perkembangan sel telur berikutnya.
2.3. Pembelahan
Gambar 4. Tahap pembentukan morula
Berbeda dengan sel somatik, sel gametofit pada manusia mengalami
pembelahan mitosis yang berlangsung secara terus-menerus tanpa istirahat. Pola
pembelahan mamalia berupa pembelahan holoblastik equal yaitu ketika
pembelahan terjadi pada seluruh bagian zigot membentuk blastomer yang sama
besar (Iwata, 2014). Proses pembelahan terjadi dalam beberapa tahap, pembelahan
pertama dan kedua terjadi di daerah meridional yaitu pembelahan secara vertikal di
tengah melewati poros kutub animal dan vegetal. Sedangkan pembelahan ketiga
terjadi secara ekuatorial yaitu pada horizontal tepat di tengah. Pembelahan seperti
itu disebut juga dengan pembelahan rotasional.
Gambar 5. Pembelahan zigot hingga proses pemadatan
Menurut Yatim (1990) pada manusia pembelahan terjadi secara holobastik
tidak teratur. Dimana bidang dan waktu tahap-tahap pembelahan tidak sama dan
tidak serentak pada berbagai daerah zigot. Jumlah sel yang terbentuk tidak
meningkat secara eksponensial tiap tahapnya, awalnya zigot membelah menjadi 2
sel, kemudian terjadi tingkat 3 sel, kemudian tingkat 4 sel, diteruskan tingkat 5 sel,
6 sel, 7 sel, 8 sel, (Hirate, 2015). Pada manusia, tahap perkembangan morula terjadi
selama hari-hari pertama dalam minggu pertama setelah pembuahan (GA minggu
3) dan digambarkan sebagai tahap Carnegie 2 (Dard, 2009). Morula ditandai
dengan terjadinya pemadatan ketika sel berjumlah 8, kemudian akan terus
membelah secara cepat membentuk 16 sel yang terdiri atas blastomere yang
tersusun rapat dan kompak. Susunan ini dikemas sangat rapat melalui perlekatan
antar membrane oleh protein adhesi seperti E-cadherin membentuk tight junction.
Struktur tersebut menghubungkan membrane sel dengan gap junction pada bagian
dalam yang berfungsi menyalurkan ion-ion serta molekul-molekul sederhana.
Tahap ini diikuti dengan pembentukan rongga, blastocoel, yang menentukan
pembentukan blastokista menyebabkan permukaan sel luar menjadi cembung dan
permukaan bagian dalam menjadi cekung. Sel membelah secara melintang dan
mulai membentuk formasi lapisan kedua secara samar pada kutub animal.
Blastomer kemudian memadat menjadi blastodisk kecil membentuk dua lapis sel.
Pada akhir pembelahan akan dihasilkan dua kelompok sel. Pertama kelompok sel-
sel utama (blastoderm), yang meliputi sel-sel formatik atau gumpalan sel-sel dalam
(inner mass cells), fungsinya membentuk tubuh embrio (Emura, 2020). Kedua
adalah kelompok sel-sel pelengkap, yang meliputi trophoblast, periblast, dan
auxilliary cells. Fungsinya melindungi dan menghubungkan embrio dengan induk
atau lingkungan luas (Chard, 1995; Mercader, 2008).
DAFTAR RUJUKAN
Bessonnard S, Mesnard D & Constam DB. (2015). “PC7 and the related
proteases Furin and Pace4 regulate E-cadherin function during blastocyst
formation”. J. Cell Biol, 210, 1185-97
Chard, Tim & Lilford, Richard (1995). “Basic sciences for obstetrics and
gynaecology”. Springer. p. 18. ISBN 978-3-540-19903-8.
Dard N, Louvet-Vallée S & Maro B. (2009). “Orientation of mitotic spindles
during the 8- to 16-cell stage transition in mouse embryos”. PLoS ONE, 4, e8171
Dzamba BJ, Jakab KR, Marsden M, Schwartz MA & DeSimone DW. (2009).
“Cadherin adhesion, tissue tension, and noncanonical Wnt signaling regulate
fibronectin matrix organization”. Dev. Cell, 16, 421-32
Emura N, Saito Y, Miura R & Sawai K. (2020). “Effect of Downregulating the
Hippo Pathway Members YAP1 and LATS2 Transcripts on Early Development
and Gene Expression Involved in Differentiation in Porcine Embryos”. Cell
Reprogram
Harris, A., Johnson, C. (2006). “Compare embryology of sea urchin, frog, bird
and mammal similarities and differences”. Journal of Embryology 104
Hirate Y, Hirahara S, Inoue K, Kiyonari H, Niwa H & Sasaki H. (2015). “Par-
aPKC-dependent and -independent mechanisms cooperatively control cell polarity,
Hippo signaling, and cell positioning in 16-cell stage mouse embryos”. Dev.
Growth Differ. 57, 544-56.
Iwata, K., Yumoto, K., Sugishima, M., Mio, Y. (2014). “Analysis of
Compaction Initiation in Human Embryos Using Time-Lapse Cinematography”.
Journal of Assisted Reproduction and Genetics
Mercader, Amparo et al. (2008). "Human embryo culture". In Lanza, Robert;
Klimanskaya, Irina (eds.). Essential stem cell methods. Academic Press. p. 343
Milachich T. (2014). “New advances of preimplantation and prenatal genetic
screening and noninvasive testing as a potential predictor of health status of
babies”. Biomed Res Int, 2014, 306505.
Yatim, W. (1994). “Reproduksi dan Embriogenesis”. Tarsito, Bandung.
Zhang P, Zucchelli M, Bruce S, Hambiliki F, Stavreus-Evers A, Levkov L,
Skottman H, Kerkelä E, Kere J & Hovatta O. (2009). “Transcriptome profiling of
human pre-implantation development”. PLoS ONE, 4, e7844. PMID: 19924284
DOI.
Anda mungkin juga menyukai
- Mikrobiologi Perubatan I: Patogen dan Mikrobiologi ManusiaDari EverandMikrobiologi Perubatan I: Patogen dan Mikrobiologi ManusiaPenilaian: 2.5 dari 5 bintang2.5/5 (2)
- Makalah Perkembangan Embrio Manusia Revisi-1Dokumen23 halamanMakalah Perkembangan Embrio Manusia Revisi-1Lutfiana AzizahBelum ada peringkat
- Mikrobiologi Medis I: Patogen dan Mikrobioma ManusiaDari EverandMikrobiologi Medis I: Patogen dan Mikrobioma ManusiaPenilaian: 4 dari 5 bintang4/5 (11)
- Makalah Perkembangan Embrio Mamalia AriadnaDokumen9 halamanMakalah Perkembangan Embrio Mamalia Ariadnaariadna safitri100% (2)
- Embriologi Modern Dan Alqur'anDokumen29 halamanEmbriologi Modern Dan Alqur'anBunga NariaBelum ada peringkat
- Perkembangan Embrio MamaliaDokumen13 halamanPerkembangan Embrio MamaliaTasafima TesariBelum ada peringkat
- Icha SRP - Makalah Fertilisasi Dan Gastrulasi1323Dokumen8 halamanIcha SRP - Makalah Fertilisasi Dan Gastrulasi1323راسیلاواتیBelum ada peringkat
- Perkembangan Embrio ManusiaDokumen23 halamanPerkembangan Embrio ManusiaJakop hutapeaBelum ada peringkat
- Makalah Embrio ManusiaDokumen12 halamanMakalah Embrio ManusiaCandra HakikiBelum ada peringkat
- Laporan EmbriogenesisDokumen17 halamanLaporan EmbriogenesisTiara WulandariBelum ada peringkat
- FertilisasiDokumen30 halamanFertilisasiIndranu Nanggala PratamaBelum ada peringkat
- FertilModulDokumen31 halamanFertilModulLidya YanuartaBelum ada peringkat
- Proses KehamilanDokumen6 halamanProses KehamilanEdwardSundoroBelum ada peringkat
- Jurnal 4 Pembelahan SelDokumen9 halamanJurnal 4 Pembelahan SelDarin WibowoBelum ada peringkat
- FERTILISASIDokumen20 halamanFERTILISASIZahra FirdausBelum ada peringkat
- LiliswahyuDokumen19 halamanLiliswahyuRistiBelum ada peringkat
- Implantasi PDFDokumen23 halamanImplantasi PDFAnnisaastikaBelum ada peringkat
- MakalaH Pembentukan JaninDokumen14 halamanMakalaH Pembentukan JaninLionel ZackBelum ada peringkat
- Implantasi Dan Plasentasi Kel.6Dokumen32 halamanImplantasi Dan Plasentasi Kel.6Alifa Rizki NP100% (2)
- Fertilisasi Dan Implantasi Kel.5Dokumen38 halamanFertilisasi Dan Implantasi Kel.5salmaafrilizaBelum ada peringkat
- Makalah Fertilisasi FixDokumen9 halamanMakalah Fertilisasi FixJesika RameBelum ada peringkat
- KATAAAKDokumen13 halamanKATAAAKchikaBelum ada peringkat
- Makalah Embriologi Tentang Fertilisasi, Implantasi, Dan Perkembangan JaninDokumen15 halamanMakalah Embriologi Tentang Fertilisasi, Implantasi, Dan Perkembangan Janinetha rananmase50% (2)
- Mekanisme FertilisasiDokumen3 halamanMekanisme FertilisasiSanti ErynaBelum ada peringkat
- Makalah Embriologi Tentang Fertilisasi Implantasi Dan Perkembangan JaninDokumen15 halamanMakalah Embriologi Tentang Fertilisasi Implantasi Dan Perkembangan JaninArtheswara SidhajatiBelum ada peringkat
- HasilDokumen4 halamanHasilyudha_oscarBelum ada peringkat
- REPRODUKSIDokumen6 halamanREPRODUKSIDiaz Ferdian MaulanaBelum ada peringkat
- BLIGHTED OVUMDokumen26 halamanBLIGHTED OVUM-Drajatz Fauzan Nardianz-Belum ada peringkat
- Tentiran Praktikum Biologi 1 Dan 2Dokumen31 halamanTentiran Praktikum Biologi 1 Dan 2Yucca CameliaBelum ada peringkat
- BAB I RepairedDokumen14 halamanBAB I RepairedHafizah ZakiahBelum ada peringkat
- Bab2 FertilisasiDokumen4 halamanBab2 FertilisasiWihel AnandaBelum ada peringkat
- TugasDokumen5 halamanTugasNANDA DESIMABelum ada peringkat
- PERKEMBANGAN JANINDokumen28 halamanPERKEMBANGAN JANINRiska Resty WasitaBelum ada peringkat
- Embriologi UmumDokumen27 halamanEmbriologi UmumRendi Siregar0% (2)
- Proses KehamilanDokumen10 halamanProses KehamilanMarthaLhtBelum ada peringkat
- Tugas Biologi Reproduksi (Islaely Amalya 105941101417) - PROSES REPRODUKSI IKAN MULAI DARI FERTILISASI SAMPAI EMBRIODokumen11 halamanTugas Biologi Reproduksi (Islaely Amalya 105941101417) - PROSES REPRODUKSI IKAN MULAI DARI FERTILISASI SAMPAI EMBRIOIslaely AmalyaBelum ada peringkat
- Pembelahan Zigot dan GastrulasiDokumen13 halamanPembelahan Zigot dan GastrulasiHanny Herzegovina50% (2)
- Pengertian JaninDokumen10 halamanPengertian JaninEsti Angra100% (1)
- Elirahma Agustina 2B KebidananDokumen22 halamanElirahma Agustina 2B Kebidananelok faiqohBelum ada peringkat
- Proses ImplantasiDokumen6 halamanProses ImplantasiNurul RifkaBelum ada peringkat
- FERTILISASIDokumen3 halamanFERTILISASI2009511022 Jazuli Azra MrBelum ada peringkat
- Fertilisasi MakalahDokumen34 halamanFertilisasi MakalahNining Nurnaningsih33% (3)
- Makalah Perkembangan Embrio AmphibiDokumen19 halamanMakalah Perkembangan Embrio AmphibiTasafima TesariBelum ada peringkat
- SELAINDUKSIDokumen6 halamanSELAINDUKSIvania ismadewiBelum ada peringkat
- Embrio Perkembangan AwalDokumen40 halamanEmbrio Perkembangan AwalIlvira Ulpa IsmailBelum ada peringkat
- Pertumbuhan Dan Perkembangan Janin:EmbrioDokumen47 halamanPertumbuhan Dan Perkembangan Janin:EmbrioDera ArmeditaBelum ada peringkat
- Bab Ii PDFDokumen294 halamanBab Ii PDFMaria Meilani SihiteBelum ada peringkat
- Proses Pembuahan dan KehamilanDokumen11 halamanProses Pembuahan dan KehamilanSan IhsanBelum ada peringkat
- GAMETOGENESISDokumen30 halamanGAMETOGENESISAndiNastitiRusmanBelum ada peringkat
- Dasar Teori Katak FiksDokumen17 halamanDasar Teori Katak FiksRizky RahmaBelum ada peringkat
- Fertilisasi, Pembelahan dan ImplantasiDokumen5 halamanFertilisasi, Pembelahan dan ImplantasiIndranu Nanggala PratamaBelum ada peringkat
- Embrio Ayam PerkembanganDokumen19 halamanEmbrio Ayam PerkembanganRafa ZalfaBelum ada peringkat
- Fertilisasi Sel GametDokumen9 halamanFertilisasi Sel GametSendi MaulanaBelum ada peringkat
- Makalah Turunan Mesoderm Dan EndodermDokumen16 halamanMakalah Turunan Mesoderm Dan Endodermmamon100% (5)
- EMBRIOGENESIS DAN FERTILISASIDokumen10 halamanEMBRIOGENESIS DAN FERTILISASIAbela Kholis31Belum ada peringkat
- Kelompok 6 (Perkembangan Embrio Manusia)Dokumen24 halamanKelompok 6 (Perkembangan Embrio Manusia)sitiBelum ada peringkat
- LINK AJADokumen23 halamanLINK AJAKarina Nur'ainiBelum ada peringkat
- Lembar Kerja Mahasiswa Pertemuan Ke 3Dokumen1 halamanLembar Kerja Mahasiswa Pertemuan Ke 3Karina Nur'ainiBelum ada peringkat
- TUGAS Protein Sel TunggalDokumen11 halamanTUGAS Protein Sel Tunggalegotz_sweetBelum ada peringkat
- Karina Nur'Aini - Kel 6 - Jurnal Kegiatan IndividuDokumen4 halamanKarina Nur'Aini - Kel 6 - Jurnal Kegiatan IndividuKarina Nur'ainiBelum ada peringkat
- Buku Desain Thinking - Pertemuan 3-29-35Dokumen7 halamanBuku Desain Thinking - Pertemuan 3-29-35Karina Nur'ainiBelum ada peringkat
- 5 6332327102062265145Dokumen65 halaman5 6332327102062265145fauzanBelum ada peringkat
- Seleksi PesertaDokumen219 halamanSeleksi PesertaKarina Nur'ainiBelum ada peringkat
- Pedoman Akademik S2Dokumen13 halamanPedoman Akademik S2Karina Nur'ainiBelum ada peringkat
- TUGAS Protein Sel TunggalDokumen11 halamanTUGAS Protein Sel Tunggalegotz_sweetBelum ada peringkat
- 5 6332327102062265145Dokumen65 halaman5 6332327102062265145fauzanBelum ada peringkat
- Pedoman Akademik S2Dokumen13 halamanPedoman Akademik S2Karina Nur'ainiBelum ada peringkat
- (Rev) Rundown Acara Science WebinarDokumen6 halaman(Rev) Rundown Acara Science WebinarKarina Nur'ainiBelum ada peringkat
- (Rev) Rundown Acara Science WebinarDokumen6 halaman(Rev) Rundown Acara Science WebinarKarina Nur'ainiBelum ada peringkat
- Produk Bioplastik Singkong untuk KeberlanjutanDokumen2 halamanProduk Bioplastik Singkong untuk KeberlanjutanKarina Nur'ainiBelum ada peringkat
- PPLM 2021Dokumen4 halamanPPLM 2021Karina Nur'ainiBelum ada peringkat
- (Rev) Susunan Acara Sambang Desa 2021Dokumen1 halaman(Rev) Susunan Acara Sambang Desa 2021Karina Nur'ainiBelum ada peringkat
- Seleksi PesertaDokumen219 halamanSeleksi PesertaKarina Nur'ainiBelum ada peringkat
- Prof. HeraDokumen3 halamanProf. HeraKarina Nur'ainiBelum ada peringkat
- BUFFER TRIS OPTIMAL UNTUK MEDIA BIOLOGISDokumen2 halamanBUFFER TRIS OPTIMAL UNTUK MEDIA BIOLOGISKarina Nur'ainiBelum ada peringkat
- Rencana Pembelajaran Biologi Mengajar Di SDN Argosari 1Dokumen2 halamanRencana Pembelajaran Biologi Mengajar Di SDN Argosari 1Karina Nur'ainiBelum ada peringkat
- Jadwal List Inbisbio Anggek Oktober 2021Dokumen3 halamanJadwal List Inbisbio Anggek Oktober 2021Karina Nur'ainiBelum ada peringkat
- Kisi-Kisi PTS Kelas 1a 1772021Dokumen2 halamanKisi-Kisi PTS Kelas 1a 1772021Karina Nur'ainiBelum ada peringkat
- Tips Lolos Pendanaan PKMDokumen5 halamanTips Lolos Pendanaan PKMKarina Nur'ainiBelum ada peringkat
- Format Dan Contoh Draft Pendahuluan BBB 2021Dokumen4 halamanFormat Dan Contoh Draft Pendahuluan BBB 2021Karina Nur'ainiBelum ada peringkat
- Determinasi + KladogramDokumen2 halamanDeterminasi + KladogramKarina Nur'ainiBelum ada peringkat
- (Rev) Susunan Acara Sambang Desa 2021Dokumen1 halaman(Rev) Susunan Acara Sambang Desa 2021Karina Nur'ainiBelum ada peringkat
- LKM3 Isolasi DNADokumen2 halamanLKM3 Isolasi DNAKarina Nur'ainiBelum ada peringkat
- Bagian KarinDokumen2 halamanBagian KarinKarina Nur'ainiBelum ada peringkat
- LKM Pengenalan InstrumentasiDokumen2 halamanLKM Pengenalan InstrumentasiKarina Nur'ainiBelum ada peringkat
- LKM 9 Genetika 2 (Modified PBL)Dokumen6 halamanLKM 9 Genetika 2 (Modified PBL)Karina Nur'ainiBelum ada peringkat