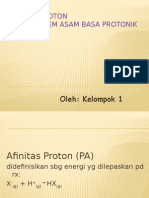
HIDROGEN
Diunggah oleh
meri hardina zd100%(1)100% menganggap dokumen ini bermanfaat (1 suara)
1K tayangan12 halamanHidrogen dan senyawanya dapat diklasifikasi sebagai hidrida logam, garam, atau molekuler. Hidrida garam terbentuk dengan unsur-unsur blok-S dan bereaksi sangat efektif dengan air, sehingga digunakan sebagai reagen pengering pelarut organik.
Deskripsi Asli:
gfgghghh
Judul Asli
HIDROGEN ppt
Hak Cipta
© © All Rights Reserved
Format Tersedia
PPTX, PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHidrogen dan senyawanya dapat diklasifikasi sebagai hidrida logam, garam, atau molekuler. Hidrida garam terbentuk dengan unsur-unsur blok-S dan bereaksi sangat efektif dengan air, sehingga digunakan sebagai reagen pengering pelarut organik.
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PPTX, PDF, TXT atau baca online dari Scribd
100%(1)100% menganggap dokumen ini bermanfaat (1 suara)
1K tayangan12 halamanHIDROGEN
Diunggah oleh
meri hardina zdHidrogen dan senyawanya dapat diklasifikasi sebagai hidrida logam, garam, atau molekuler. Hidrida garam terbentuk dengan unsur-unsur blok-S dan bereaksi sangat efektif dengan air, sehingga digunakan sebagai reagen pengering pelarut organik.
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PPTX, PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 12
HIDROGEN
Hidrogen dan Senyawanya
Hidrogen adalah unsur paling melimpah di alam
semesta, dan merupakan ketiga yang paling
berlimpah di bumi.
hidrogen adalah gas diatomik. Karena entalpi
disosiasi ikatannya tinggi , H2 tidak dianggap sangat
reaktif.
Hidrogen dapat ditemukan sebagai protium (1H, D
H2 = 436 kJ/mol
99.985%), dan deuterium (2H, ~sisanya %). Tritium
(3H) juga dikenal, tetapai hanya terdapat satu bagian
dalam 1017 atom!
Tritium radioaktif, dengan waktu paruh12,4 tahun:
0
3
1 H He
3
2 1e
a radioactive decay process called -d
H, H+, and H-
Hidrogen dapat mempunyai bilangan oksidasi positif atau
negatif.
Karena H tidak sangat elektronnegatif, bila berikatan dg non-
logam yang lebih elektronegatif spt F, N, O, akan mem eiliki
bilangan oksidasi positif. (e.g. HF, H2O, NH3)
Ctt: bilangan oksidasi
hydrogen ion, H+: Lewis acid H-Cl bukan muatan
+1 -1
H lebih elektronegatif dari logam, dan dengan demikian memiliki bilangan oksidasi negatif dibanding logam
spt dalam kasus-kasus ( hidrida - CaH2, LiH)
Na H
+ -
hydride ion, H-: Lewis base
Bila berikatan dengan non-logam yg elektronegativitas hampir sama (misalnya C, P, B), merupakan ikatan
non-polar (CH4, PH3, BH3)
(H still carries positive oxidation number here)
Generating Hydrogen
Dalam keadaan alamiah (H2(g) hidrogen tidak terlalu
melimpah (~ 6x10-5%), tapi H2(g) dapat dihasilkan
dalam jumlah kecil melalui reaksi hidrida logam
dengan air:
NaH + H2O H2(g) + NaOH
reaksi logam alkali dengan air :
2Na(s) + 2H2O H2(g) + 2NaOH
atau reaksi asam dengan logam:
2H+ + Zn(s) H2(g) + Zn2+
(pada reaksi di atas, seng mereduksi H+ menjadi H2(g))
Hidrogen
Secara komersil, hidrogen diproduksi melalui cracking
hidrokarbon sementara alkena dihasilkan :
C2H6(g) C2H4(g) + H2(g)
Cara lain memperoleh gas hidrogen adalah melalui reaksi
pergeseran air-gas:
Ni catalyst, 1200K
H2O(g) + CH4(g) CO(g) + 3H2(g)
water-gas
FeO catalyst, 700K shift reaction
CO(g) + H2O(g) CO2(g) + H2(g)
Penggunaan Hidrogen
Hidrogen digunakan secara luas dalam
reaksi kimia untuk mereduksi (hidrogenasi)
di laboratorium anorganik dan organik.
H2(g) + RCHO RCH2OH (catalyzed)
Contoh: H2 dapat digunakan untuk
mereduksi oksida logam menjadi logam
MO2(s) + H2(g) M(s) + H2O(l) (catalyzed rxn)
M2O3(s) + 3H2(g) 2M(s) + 3H2O(l)
Penggunaan Hidrogen
Mungkin potensi penggunaanyang paling penting
dari hidrogen sebagai bahan bakarfuel
Reaksi kimia H2(g) dan O2(g) menghasilkan banyak energi
(reaksi ini mendorong pesawat ruang angkasa ke ruang
angkasa saat tinggal landas)
Reaksi tidak menghasilkan emisi dan jadi mrp sumber
energi yang bersih (zero emission fuel)
Ada masalah besar untuk skenario ini:
Kelimpahan yg rendah dariH2(g)
Biaya (juga energi) dalam memproduksi gas hidrogen
Portabilitas / masalah penyimpanan (H2 memiliki rasio
disimpan rendah energi-untuk-volume jika dibandingkan
dengan bahan bakar organik lainnya).
Hidrida logam mungkin menawarkan solusi untuk ini.
Penggunaan Hidrogen
Sel bahan bakar adalah alternatif lain:
2H+(aq) + O2-(aq) H2O(l)
Reaksi yang melibatkan oksidasi hidrogen (H adalah bahan
bakar) dan reduksi oksigen (dari udara). Arus mengalir sebagai
elektron dikeluarkan dari H dan ditambahkan ke O
Sumber H :
H2(g) (lihat slide sebelumnya)
Sumber organik(CH3OH, etc.)
WAir?
Sumber organik sources akan menghasilkan CO 2(g)
greenhouse gas. Called reduced emission fuels
Ikatan dan Hidrogen
Hidrogen terlibat dalam sejumlah skema ikatan
yang berbeda
1. Hidrogen dalam hidrida non-stoichiometrik
(example, LaH2.87)
2. Jembatan 3c, 2e- bridges: hidrogen can bridge
kompleks logam transisi and unsur yg kekurangan
electron:
H H H Try the Lewis structure for B2H6:
B B
H B: 3e- x 2 = 6e-
H H H: 1 e- x 6 = 6e-
Total = 12e- for 8 atoms
a bridging hydrogen (3 centers, 2 electrons) Cant draw single covalent bonds
for everything, or multiple bonds
Ikatan dan Hidrogen: ikatan-H
Sering, ikatan hidrogen secara nyata akan
mempengaruhi sifat fisik molekul/senyawa
(misalnya titik didih) dan bahkan reaktivitas
(interaksi banyak obat dengan tubuh kita
tergantung pada ikatan hidrogen
Ikatan hidrogen terbentuk antara atom H
dengan atom elektronegatif dan atom
elektronegatif yang memiliki pasangan
elektron.
an intermolecular
Ikatan hidrogen antarmolekul adalah ikatanH-bond (longer than
yg terdapat antara dua molekul. typical H-F bond)
I Ikatan hidrogen intramolekul terdapat
antara atom-atom pada molekul yg sama
H-Bonding
Hal ini jelas bahwa dengan
meningkatnya berat molekul,
titik didih dan leleh meningkat
sebagai akibat dari gaya
antarmolekul meningkat
(dispersi)
Kecuali untuk kasus pertama di
setiap seri, gaya dispersi
menentukan titik didih
Untuk hidrida pertama
setiap golongan , ikatan- H
merupakan faktor penentu
titik didih dan titik leleh.
What would be the expected boiling point of water
in the absence of H-bonding?
Klasifikasi Hidrides
Hidrida merupan senyawa jenis ExHy, dimana E adalah logam
atau non-logam
Hidrida dapat diklasifikasikan sebagai hidrida logam, garam, atau
molekuler
Hidrida garam terbentuk dengan unsur-unsur blok-S (sangat
elektropositif). Hidrida tersebut non-volatie,tidak menghantar listrik, dan
berupa kristal. Mereka cukup larut dalam pelarut organik.
Hidrida garam menunjukkan sifat kimia sangat aktif bila direaksikan dg air
NaH(s) + H2O(l) H2(g) + NaOH(aq)
CaH2(s) + H2O(l) H2(g) + Ca(OH)2(aq)
Karena mereka bereaksi begitu efektif dengan air, senyawa ini
kadang-kadang digunakan sebagai reagen untuk pengeringan
pelarut organik (misalnya CaH2 digunakan untuk
mengeringkan DMF, asetonitril)
Anda mungkin juga menyukai
- Materi AldehidDokumen17 halamanMateri AldehidYullin Lololuan MaselaBelum ada peringkat
- Alkil Halida Reaksi Substitusi Nukleofilik Dan Eliminasi-1Dokumen64 halamanAlkil Halida Reaksi Substitusi Nukleofilik Dan Eliminasi-1Dwi Evi IndriyaniBelum ada peringkat
- Biokim Latihan SoalDokumen14 halamanBiokim Latihan SoalMarisa de FretesBelum ada peringkat
- HidrogenDokumen13 halamanHidrogenclaudianurienditaBelum ada peringkat
- Afinitas Proton SelesaiDokumen10 halamanAfinitas Proton SelesaiDEsita TrianaBelum ada peringkat
- Boron TrihalidaDokumen4 halamanBoron TrihalidamasrBelum ada peringkat
- Instrumen Penilaian KognitifDokumen27 halamanInstrumen Penilaian KognitifMely AgustiBelum ada peringkat
- HalogenDokumen11 halamanHalogenRahmi IskandarBelum ada peringkat
- Golongan Nitrogen - CompressedDokumen49 halamanGolongan Nitrogen - CompressedElfrida RumanBelum ada peringkat
- Asam Basa PelarutDokumen5 halamanAsam Basa Pelarutjoe 45Belum ada peringkat
- FOTOKIMIADokumen12 halamanFOTOKIMIADedekBelum ada peringkat
- Asam Basa Keras LunakDokumen5 halamanAsam Basa Keras LunakvivifitriaaBelum ada peringkat
- Potensial Kimia Dan Energi GibbsDokumen4 halamanPotensial Kimia Dan Energi GibbsAndreas Cristian Manik100% (1)
- Kimia Polimer USU PDFDokumen24 halamanKimia Polimer USU PDFAckmad ZhealBelum ada peringkat
- Teori Oktet Dan Nomor Atom Efektif (NAE) Teori Ikatan ValensiDokumen30 halamanTeori Oktet Dan Nomor Atom Efektif (NAE) Teori Ikatan ValensiAidafuaiBelum ada peringkat
- Sio 2Dokumen3 halamanSio 2phuzz_fumi3063Belum ada peringkat
- Buku Kimia Anorganik III PGMIPA-U 2017Dokumen13 halamanBuku Kimia Anorganik III PGMIPA-U 2017Habib WijayaBelum ada peringkat
- Kunci Jawaban Bab vIII Golongan KarbonDokumen3 halamanKunci Jawaban Bab vIII Golongan KarbonDesima SamosirBelum ada peringkat
- Diagram LatimerDokumen2 halamanDiagram LatimerlindaBelum ada peringkat
- Ikatan Logam New 2016Dokumen41 halamanIkatan Logam New 2016Yane AngelaBelum ada peringkat
- Adisi Elektrofilik Dan Nukleofilik Pada AlkenaDokumen17 halamanAdisi Elektrofilik Dan Nukleofilik Pada Alkenahera hmBelum ada peringkat
- LarutanDokumen73 halamanLarutanFemi Juana Putri GintingBelum ada peringkat
- Jawaban Anorganik 3Dokumen5 halamanJawaban Anorganik 3Anisa UmaBelum ada peringkat
- Tugas PVCDokumen45 halamanTugas PVCAchmad Fathony100% (1)
- Kimia Anorganik IiDokumen12 halamanKimia Anorganik IiPirahhBelum ada peringkat
- SKANDIUMDokumen8 halamanSKANDIUMRindahBelum ada peringkat
- Diktat Praktikum Kimia Anorganik-2012Dokumen31 halamanDiktat Praktikum Kimia Anorganik-2012Akil LadzinrankBelum ada peringkat
- Unsur Aktinida Dan LantanidaDokumen47 halamanUnsur Aktinida Dan LantanidaElsaBelum ada peringkat
- Baterai Dan KorosiDokumen10 halamanBaterai Dan KorosiIlma Inaroh AzizahBelum ada peringkat
- SkandiumDokumen23 halamanSkandiumpeter sihotangBelum ada peringkat
- Air Laut Sebagai Larutan Kimia 3.8 - 3.14Dokumen30 halamanAir Laut Sebagai Larutan Kimia 3.8 - 3.14Endang SulandriBelum ada peringkat
- DAMPAK - PEMBAKARAN - MINYAK - BUMI Tugas MGMP CHRISDokumen14 halamanDAMPAK - PEMBAKARAN - MINYAK - BUMI Tugas MGMP CHRISmianBelum ada peringkat
- Reaksi OksigenDokumen5 halamanReaksi OksigenAlif Priyanka Adhy PutraBelum ada peringkat
- Nitrogen Kelompok IIIDokumen29 halamanNitrogen Kelompok IIIRisna AmaliaBelum ada peringkat
- Makalah Ir RamanDokumen16 halamanMakalah Ir Ramansiti mastiahBelum ada peringkat
- Kimia Organik IIDokumen33 halamanKimia Organik IIDaneAoneBelum ada peringkat
- Percobaan 1 (Reaksi-Reaksi Senyawa Golongan Utama)Dokumen18 halamanPercobaan 1 (Reaksi-Reaksi Senyawa Golongan Utama)Ria riona Syarif50% (2)
- Senyawa OrganologamDokumen21 halamanSenyawa OrganologamSuci Aulia RahmiBelum ada peringkat
- PRINSIP DASAR KromatografiDokumen8 halamanPRINSIP DASAR KromatografiIndra Septian FauziBelum ada peringkat
- VanadiumDokumen11 halamanVanadiumSofia MaratiBelum ada peringkat
- Oksida Dan Senyawa CRDokumen29 halamanOksida Dan Senyawa CRDesyrula Affandy Citra50% (2)
- Jawaban Soal Golongan Halogen Kelompok 4Dokumen8 halamanJawaban Soal Golongan Halogen Kelompok 4ChandraBelum ada peringkat
- Soal Kaf Pendidikan Kimia 18-ADokumen7 halamanSoal Kaf Pendidikan Kimia 18-Adevy ridaBelum ada peringkat
- Makalah Tentang TimbalDokumen18 halamanMakalah Tentang TimbalEndangBelum ada peringkat
- Aluminium Dan Senyawa-SenyawanyaDokumen14 halamanAluminium Dan Senyawa-SenyawanyaOkto FirmantriBelum ada peringkat
- GALIUMDokumen9 halamanGALIUMBingu JiddanBelum ada peringkat
- Proses Pembuatan Fosfor Dengan Proses WohlerDokumen9 halamanProses Pembuatan Fosfor Dengan Proses WohlerQomardePeBelum ada peringkat
- Sifat Fisika Dan Kimia Unsur Transisi Periode Ke 4Dokumen14 halamanSifat Fisika Dan Kimia Unsur Transisi Periode Ke 4ristaBelum ada peringkat
- Tugas Analitik 3Dokumen7 halamanTugas Analitik 3Cici ApriliaBelum ada peringkat
- Spektra 1Dokumen24 halamanSpektra 1Andriana Kusuma PertiwiBelum ada peringkat
- PDF 20220915 122131 0000Dokumen46 halamanPDF 20220915 122131 0000Nazira Fachrani SetiadyBelum ada peringkat
- HIDROGEN KIMIA AnorganikDokumen20 halamanHIDROGEN KIMIA AnorganikUmi YasifunBelum ada peringkat
- Kuliah K Anorganik I 3Dokumen28 halamanKuliah K Anorganik I 3William SuryaBelum ada peringkat
- Kimia Unsur FixDokumen14 halamanKimia Unsur FixAl KhawarizmiBelum ada peringkat
- UntitledDokumen15 halamanUntitledZahara RahmaBelum ada peringkat
- Golongan 1 - HidrogenDokumen20 halamanGolongan 1 - HidrogenAntonia Anetha Binar BulanBelum ada peringkat
- Bagi Tugas Kel. 5 - Kimia Unsur Golongan UtamaDokumen11 halamanBagi Tugas Kel. 5 - Kimia Unsur Golongan UtamaMaria FitrianiBelum ada peringkat
- Kimia HidrogenDokumen9 halamanKimia Hidrogenmuhammad qodryBelum ada peringkat
- Kimdas - Kelompok 3-Hidrogen, Oksigen, Nitrogen, Karbon, Halogen, Dan Gas MuliaDokumen44 halamanKimdas - Kelompok 3-Hidrogen, Oksigen, Nitrogen, Karbon, Halogen, Dan Gas MuliaUlfiatunBelum ada peringkat
- Kimia Senyawa HidridaDokumen3 halamanKimia Senyawa HidridaAnggie KrisnawantiBelum ada peringkat
- Materi Reaksi Radikal Bebas - NEWDokumen12 halamanMateri Reaksi Radikal Bebas - NEWmeri hardina zdBelum ada peringkat
- OrganologamDokumen29 halamanOrganologammeri hardina zd100% (1)
- Kelompok SanitasiDokumen43 halamanKelompok Sanitasimeri hardina zdBelum ada peringkat
- 02 GravimetriDokumen15 halaman02 Gravimetrimeri hardina zdBelum ada peringkat
- 2-Lingkungan Hidup & MasalahDokumen36 halaman2-Lingkungan Hidup & Masalahmeri hardina zdBelum ada peringkat
- Kimfis PraktikumDokumen17 halamanKimfis Praktikummeri hardina zdBelum ada peringkat
- Wa010Dokumen16 halamanWa010meri hardina zdBelum ada peringkat
- Kongfigurasi Molekul FixDokumen17 halamanKongfigurasi Molekul Fixmeri hardina zdBelum ada peringkat
- Teknik & Instrumen Penilaian AutentikDokumen34 halamanTeknik & Instrumen Penilaian Autentikmeri hardina zd90% (10)
- Teori Orbital MolekulDokumen25 halamanTeori Orbital Molekulmeri hardina zdBelum ada peringkat
- Reaksi Orde3Dokumen23 halamanReaksi Orde3meri hardina zdBelum ada peringkat