Siklus Karbon Dan Sistem Karbonat Di Perairan
Diunggah oleh
Agri Wahyu0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
93 tayangan2 halamanSiklus karbon di laut melibatkan pertukaran karbon antara atmosfer dan laut melalui proses upwelling dan downwelling. Karbon di laut terutama berbentuk ion bikarbonat. pH laut dipengaruhi oleh konsentrasi karbon dioksida dan reaksi karbonat, serta berperan mengontrol laju reaksi kimia di perairan.
Deskripsi Asli:
Judul Asli
SIKLUS KARBON DAN SISTEM KARBONAT DI PERAIRAN
Hak Cipta
© © All Rights Reserved
Format Tersedia
DOCX, PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniSiklus karbon di laut melibatkan pertukaran karbon antara atmosfer dan laut melalui proses upwelling dan downwelling. Karbon di laut terutama berbentuk ion bikarbonat. pH laut dipengaruhi oleh konsentrasi karbon dioksida dan reaksi karbonat, serta berperan mengontrol laju reaksi kimia di perairan.
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
93 tayangan2 halamanSiklus Karbon Dan Sistem Karbonat Di Perairan
Diunggah oleh
Agri WahyuSiklus karbon di laut melibatkan pertukaran karbon antara atmosfer dan laut melalui proses upwelling dan downwelling. Karbon di laut terutama berbentuk ion bikarbonat. pH laut dipengaruhi oleh konsentrasi karbon dioksida dan reaksi karbonat, serta berperan mengontrol laju reaksi kimia di perairan.
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 2
SIKLUS KARBON DAN SISTEM KARBONAT DI PERAIRAN
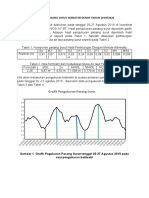
Gambar. Siklus Karbon di Lautan
Laut mengandung sekitar 36.000 gigaton karbon, dimana sebagian besar dalam bentuk ion
bikarbonat. Karbon anorganik, yaitu senyawa karbon tanpa ikatan karbon-karbon atau karbon-
hidrogen. Pertukaran karbon ini menjadi penting dalam mengontrol pH di laut dan juga dapat
berubah sebagai sumber (source) atau lubuk (sink) karbon. Pada daerah upwelling, karbon
dilepaskan ke atmosfer. Sebaliknya, pada daerah downwelling karbon (CO2) berpindah dari
atmosfer ke lautan. Pada saat CO2 memasuki lautan, asam karbonat terbentuk:
CO2 + H2O ⇌ H2CO3
Reaksi ini memiliki sifat dua arah, mencapai sebuah kesetimbangan kimia. Reaksi lainnya
yang penting dalam mengontrol nilai pH lautan adalah pelepasan ion hidrogen dan bikarbonat.
Reaksi ini mengontrol perubahan yang besar pada pH.
H2CO3 ⇌ H+ + HCO3-
Sistem karbonat merupakan Kesetimbangan asam basa mempengaruhi sistem karbonat di
perairan. Dimana derajat keasaman (pH) merupakan suatu indeks kadar ion hidrogen (H+) yang
mencirikan kesetimbangan asam dan basa. Biasanya angka pH dalam suatu perairan dapat
dijadikan indikator dari adanya keseimbangan unsur – unsur kimia. Fungsi dari pH ini sangat
penting sebagai paraneter kualitas air karena ia mengontrol tipe dan laju keeptan reaksi beberapa
bahan di dalam air. Tinggi atau rendahnya nilai pH air tergantung pada beberapa faktor yaitu:
1) Konsentrasi gas-gas dalam air seperti CO2
2) Konsentrasi garam-garam karbonat dan bikarbonat
3) Proses dekomposisi bahan organik di dasar perairan.
Secara alamiah, pH perairan dipengaruhi oleh konsentrasi karbondioksida (CO2) dan
senyawa bersifat asam. Perairan umum dengan aktivitas fotosintesis dan respirasi organisme
yang hidup didalamnya akan membentuk reaksi berantai karbonat – karbonat sebagai berikut:
CO2 + H2O è H2CO3 è H+ + HCO3 è 2H+ + CO32-
Semakin banyak CO2 yang dihasilkan dari hasil respirasi, reaksi bergerak ke kanan dan
secara bertahap melepaskan ion H+ yang menyebabkan pH air turun. Reaksi sebaliknya terjadi
pada peristiwa fotosintesis yang membutuhkan banyak ion CO2, sehingga menyebabkan pH air
naik. Pada peristiwa fotosintesis, fitoplankton dan tanaman air lainnya akan mengambil CO2 dari
air selama proses fotosintesis sehingga mengakibatkan pH air meningkat pada siang hari dan
menurun pada waktu malam hari. Untuk nilai pHnya sendiri yaitu saat netral pH = 7, saat
keadaan basa pH > 7 dan saat asam pH < 7. Pertukaran karbon menjadi penting dalam
mengontrol pH di laut dan juga dapat berubah sebagai sumber (source) atau lubuk (sink) karbon.
Karbon siap untuk saling dipertukarkan antara atmosfer dan lautan. Pada daerah upwelling,
karbon dilepaskan ke atmosfer. Sebaliknya, pada daerah downwelling karbon (CO2) berpindah
dari atmosfer ke lautan. Pada saat CO2 memasuki lautan, asam karbonat terbentuk:
CO2 + H2O ⇌ H2CO3
Reaksi ini memiliki sifat dua arah, mencapai sebuah kesetimbangan kimia. Reaksi lainnya
yang penting dalam mengontrol nilai pH lautan adalah pelepasan ion hidrogen dan bikarbonat.
Reaksi ini mengontrol perubahan yang besar pada pH:
H2CO3 ⇌ H+ + HCO3−
Anda mungkin juga menyukai
- 09E01756Dokumen0 halaman09E01756Sya'roni ImamBelum ada peringkat
- Analisis Metode Minyak dan LemakDokumen11 halamanAnalisis Metode Minyak dan LemakIrawan SurdaniBelum ada peringkat
- Makalah Ilmu Bahan Makanan LanjutDokumen12 halamanMakalah Ilmu Bahan Makanan LanjutQomarianaBelum ada peringkat
- Ujian UrineDokumen30 halamanUjian Urinesepti handayaniBelum ada peringkat
- AsidimetriDokumen3 halamanAsidimetriBima Nur PriambudiBelum ada peringkat
- Laporan Praktikum Kimling Inri Evelin Percobaan 3CDokumen19 halamanLaporan Praktikum Kimling Inri Evelin Percobaan 3CPutra Dwi Alamsyah M.TahiliBelum ada peringkat
- Metabolisme MineralDokumen51 halamanMetabolisme Mineralhendra ariBelum ada peringkat
- Kelompok 5 - Alkil Halida - 2CDokumen16 halamanKelompok 5 - Alkil Halida - 2CDayuBelum ada peringkat
- Penentuan Kadar BesiDokumen10 halamanPenentuan Kadar BesiPurparkerz Takia'genjy Emo'VanquizherBelum ada peringkat
- III - KarbohidratDokumen58 halamanIII - KarbohidratRiza Nur RamadhanBelum ada peringkat
- PKM GT 12 Klarana UNHAS Robot PustakawanDokumen11 halamanPKM GT 12 Klarana UNHAS Robot PustakawanAkhmad MuttaqinBelum ada peringkat
- Mikrobiologi IndustriDokumen8 halamanMikrobiologi IndustriMusa1994Belum ada peringkat
- Dessy - Nursetia: PENENTUAN KADAR KARBOHIDAT DENGAN METODE ANTHRONEDokumen7 halamanDessy - Nursetia: PENENTUAN KADAR KARBOHIDAT DENGAN METODE ANTHRONEAsep Iwan PurnawanBelum ada peringkat
- Analisis Kadar Abu Dan MineralDokumen5 halamanAnalisis Kadar Abu Dan MineralLinaWinatiBelum ada peringkat
- LOGAM BERAT DAN KROMDokumen13 halamanLOGAM BERAT DAN KROMAnonymous uyoKa7GXZBelum ada peringkat
- Jurnal Wiyata BayuDokumen7 halamanJurnal Wiyata BayuDanteBelum ada peringkat
- Penentuan Fosfat Kel 2 - (1) - 1Dokumen24 halamanPenentuan Fosfat Kel 2 - (1) - 1RisaratihBelum ada peringkat
- KromiumDokumen13 halamanKromiumFifi Wijaya100% (1)
- Pengawetan - Pengalengan BuahDokumen12 halamanPengawetan - Pengalengan BuahSophia IPBelum ada peringkat
- BTM-FUNGSIDokumen24 halamanBTM-FUNGSIDedi SupriantoBelum ada peringkat
- Reaksi-Reaksi Kimia Di PerairanDokumen26 halamanReaksi-Reaksi Kimia Di PerairanSriyanti ZainalBelum ada peringkat
- Pemutih Pematang Tepung, Dan PengerasDokumen16 halamanPemutih Pematang Tepung, Dan PengerasEndang FebriantikaBelum ada peringkat
- Pektin PanganDokumen16 halamanPektin PanganMutia DewiBelum ada peringkat
- Laporan Praktikum Kimia Pangan Abu Mineral DewiDokumen20 halamanLaporan Praktikum Kimia Pangan Abu Mineral DewiDewi Siti NurfazriahBelum ada peringkat
- BIKLIN 3 - Kalsium DarahDokumen8 halamanBIKLIN 3 - Kalsium DarahDievaSetyatamaBelum ada peringkat
- Bakteri ColiformDokumen7 halamanBakteri Coliformshazhan828100% (1)
- Analisis Pemeriksaan Mikrobiologis MakminDokumen53 halamanAnalisis Pemeriksaan Mikrobiologis Makmineko1980100% (1)
- Metabolisme Energi OlahragaDokumen7 halamanMetabolisme Energi OlahragaAlfa LailiBelum ada peringkat
- Revisi - Review Jurnal PH Meter 2B-19BDokumen15 halamanRevisi - Review Jurnal PH Meter 2B-19BdodoBelum ada peringkat
- Pengukuran Kadar Vitamin Larut LemakDokumen6 halamanPengukuran Kadar Vitamin Larut Lemak2.Farhan SidiqBelum ada peringkat
- Susu UhtDokumen51 halamanSusu UhtmayaBelum ada peringkat
- Kelompok 2 - AP2 - Laporan Darah IDokumen8 halamanKelompok 2 - AP2 - Laporan Darah ITri Wahyu KodradiBelum ada peringkat
- Analisis Pemanis CupDokumen23 halamanAnalisis Pemanis CupHidayat Akbar100% (2)
- Critical Book Report Kelompok 2Dokumen23 halamanCritical Book Report Kelompok 2Shohihatun BariyahBelum ada peringkat
- Uji Iodin Pada Kondisi Asam Basa NetralDokumen1 halamanUji Iodin Pada Kondisi Asam Basa NetralXx YyBelum ada peringkat
- Asam FormiatDokumen76 halamanAsam FormiatshelaBelum ada peringkat
- Analisa Air SungaiDokumen22 halamanAnalisa Air SungaiRoselina JayantiBelum ada peringkat
- KEADAAN CAIRDokumen25 halamanKEADAAN CAIRYeni AuliaBelum ada peringkat
- PERCOBAAN 4-Penetapan Kadar Protein TotalDokumen16 halamanPERCOBAAN 4-Penetapan Kadar Protein TotalranipratiwiekaBelum ada peringkat
- Makalah Kimia Fisika 2 (Surfaktan) - FixedDokumen28 halamanMakalah Kimia Fisika 2 (Surfaktan) - FixedTalitha ZagitaBelum ada peringkat
- Makalah AsiditasDokumen26 halamanMakalah AsiditasAdhy Suparsa100% (3)
- Analisis Pangan HCNDokumen8 halamanAnalisis Pangan HCNGrisselda Priliacita100% (1)
- Jurnal Dan Laporan p3 Urine (Rahmah Khairunnisa-24030116140097)Dokumen39 halamanJurnal Dan Laporan p3 Urine (Rahmah Khairunnisa-24030116140097)Ika ChasaBelum ada peringkat
- Suhendrayatna PDFDokumen9 halamanSuhendrayatna PDFNasrul AzizBelum ada peringkat
- LAPORAN Percobaan 3 - G30119039 Shara Aulia Ramadhani (AutoRecovered)Dokumen19 halamanLAPORAN Percobaan 3 - G30119039 Shara Aulia Ramadhani (AutoRecovered)Sara RamadaniBelum ada peringkat
- MakananUntukPemulihanDokumen6 halamanMakananUntukPemulihanWidya KBelum ada peringkat
- PRAKTIKUM KIMIA DASAR 1Dokumen31 halamanPRAKTIKUM KIMIA DASAR 1arjun maulanaBelum ada peringkat
- ANALISIS PROTEIN DENGAN METODE BRADFORDDokumen20 halamanANALISIS PROTEIN DENGAN METODE BRADFORDNesihBelum ada peringkat
- Analisis Kandungan Logam Pada Air, SedimenDokumen67 halamanAnalisis Kandungan Logam Pada Air, SedimenMisika AlamBelum ada peringkat
- OPTIMASI ESI S2Dokumen29 halamanOPTIMASI ESI S2Hasri NinisBelum ada peringkat
- VoltametriDokumen12 halamanVoltametriYunita SariBelum ada peringkat
- Analisa Kuantitatif Aktivitas EnzimDokumen11 halamanAnalisa Kuantitatif Aktivitas Enzimfadlizah arisBelum ada peringkat
- Jawaban Pertanyaan Penentuan Kadar ProteinDokumen2 halamanJawaban Pertanyaan Penentuan Kadar ProteinEva Rizka AmaliaBelum ada peringkat
- ISOTOP FARMASIDokumen7 halamanISOTOP FARMASIFitriya Diskie T. ZeesBelum ada peringkat
- Identifikasi Boraks Dalam MakananDokumen14 halamanIdentifikasi Boraks Dalam MakananIndra Wijaya100% (1)
- Kelompok 5 - Verifikasi Metode Penentuan Krom Heksavalen Secara Spektrofotometri UV-VIS Double BeamDokumen6 halamanKelompok 5 - Verifikasi Metode Penentuan Krom Heksavalen Secara Spektrofotometri UV-VIS Double Beamaprilia kurnia putriBelum ada peringkat
- OPTIMASI KONDUKTOMETRIDokumen29 halamanOPTIMASI KONDUKTOMETRIOvia ReskiBelum ada peringkat
- Makalah Kimia Air 8Dokumen31 halamanMakalah Kimia Air 8RedhaRezianaBelum ada peringkat
- Tugas Kimia LingkunganDokumen4 halamanTugas Kimia LingkunganNaniekBelum ada peringkat
- ALKALINITASDokumen8 halamanALKALINITASDien RifkiBelum ada peringkat
- Arthur Mattews BasanaDokumen3 halamanArthur Mattews BasanaAgri WahyuBelum ada peringkat
- Agri Wahyu Liandra - 26050118130124 - Oseanografi C - UTS PasutDokumen4 halamanAgri Wahyu Liandra - 26050118130124 - Oseanografi C - UTS PasutAgri WahyuBelum ada peringkat
- Agri Wahyu Liandra - 26050118130124 - Oseanografi - C - Tugas GeofisikaDokumen3 halamanAgri Wahyu Liandra - 26050118130124 - Oseanografi - C - Tugas GeofisikaAgri WahyuBelum ada peringkat
- Upwelling dan Tipe-Tipe UpwellingDokumen3 halamanUpwelling dan Tipe-Tipe UpwellingAgri WahyuBelum ada peringkat
- Overlay Adalah Prosedur Penting Dalam Analisis SIGDokumen3 halamanOverlay Adalah Prosedur Penting Dalam Analisis SIGAgri WahyuBelum ada peringkat
- Agri Wahyu Liandra - 26050118130124 - Oseanografi - C - SIKDokumen8 halamanAgri Wahyu Liandra - 26050118130124 - Oseanografi - C - SIKAgri WahyuBelum ada peringkat
- QuizDokumen7 halamanQuizAgri WahyuBelum ada peringkat
- Agri Wahyu Liandra - 26050118130124 - Oseanografi - C - UTS SIKDokumen2 halamanAgri Wahyu Liandra - 26050118130124 - Oseanografi - C - UTS SIKAgri WahyuBelum ada peringkat
- Cover QuizDokumen1 halamanCover QuizAgri WahyuBelum ada peringkat
- Agri Wahyu Liandra 26050118130124 Oseanografi C SIK 6Dokumen3 halamanAgri Wahyu Liandra 26050118130124 Oseanografi C SIK 6Agri WahyuBelum ada peringkat
- Upwelling dan Tipe-Tipe UpwellingDokumen3 halamanUpwelling dan Tipe-Tipe UpwellingAgri WahyuBelum ada peringkat
- Agri Sig UtsDokumen2 halamanAgri Sig UtsAgri WahyuBelum ada peringkat
- GelombangDokumen1 halamanGelombangAgri WahyuBelum ada peringkat
- Agri Wahyu Liandra - 26050118130124 - Oseanografi - C - SIKDokumen8 halamanAgri Wahyu Liandra - 26050118130124 - Oseanografi - C - SIKAgri WahyuBelum ada peringkat
- Agri Wahyu Liandra - 26050118130124 - Oseanografi - C - MetnumDokumen7 halamanAgri Wahyu Liandra - 26050118130124 - Oseanografi - C - MetnumAgri WahyuBelum ada peringkat
- EKSPLORASI MINYAK DASAR LAUTDokumen5 halamanEKSPLORASI MINYAK DASAR LAUTAgri WahyuBelum ada peringkat
- CV AgriDokumen1 halamanCV AgriAgri WahyuBelum ada peringkat
- Soal Modul 5Dokumen2 halamanSoal Modul 5Agri WahyuBelum ada peringkat
- Agri Wahyu Liandra - 26050118130124 - Oseanografi - C - Kuis KimlingDokumen4 halamanAgri Wahyu Liandra - 26050118130124 - Oseanografi - C - Kuis KimlingAgri WahyuBelum ada peringkat
- Agri Wahyu Liandra - 26050118130124 - Oseanografi - C - Quiz KimlingDokumen3 halamanAgri Wahyu Liandra - 26050118130124 - Oseanografi - C - Quiz KimlingAgri WahyuBelum ada peringkat
- Tugas Pak KunDokumen2 halamanTugas Pak KunAgri WahyuBelum ada peringkat
- Pak KunDokumen5 halamanPak KunAgri WahyuBelum ada peringkat
- Soal Modul 4Dokumen3 halamanSoal Modul 4Agri WahyuBelum ada peringkat
- Agri Wahyu Liandra - 26050118130124 - Oseanografi - C - Kuis KimlingDokumen4 halamanAgri Wahyu Liandra - 26050118130124 - Oseanografi - C - Kuis KimlingAgri WahyuBelum ada peringkat
- Tugas SIK Kelompok 4 Oseanografi CDokumen8 halamanTugas SIK Kelompok 4 Oseanografi CAgri WahyuBelum ada peringkat
- Agri Wahyu Liandra - 26050118130124 - Oseanografi - C - SIKDokumen2 halamanAgri Wahyu Liandra - 26050118130124 - Oseanografi - C - SIKAgri WahyuBelum ada peringkat
- LANGKAH PENGOPERASIAN WATER SAMPLER & BOLA DUGADokumen3 halamanLANGKAH PENGOPERASIAN WATER SAMPLER & BOLA DUGAAgri WahyuBelum ada peringkat
- Agri Wahyu Liandra - 26050118130124 - Oseanografi - C - SIKDokumen2 halamanAgri Wahyu Liandra - 26050118130124 - Oseanografi - C - SIKAgri WahyuBelum ada peringkat
- Agri Wahyu Liandra - 26050118130124 - Oseanografi - C - SIKDokumen2 halamanAgri Wahyu Liandra - 26050118130124 - Oseanografi - C - SIKAgri WahyuBelum ada peringkat