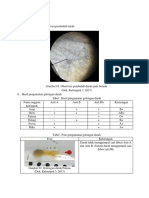
DASAR TEORI Denaturasi
Diunggah oleh
Dewi Kusuma NingtyasHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
DASAR TEORI Denaturasi
Diunggah oleh
Dewi Kusuma NingtyasHak Cipta:
Format Tersedia
DASAR TEORI
Protein adalah salah satu biomolekul raksasa yang berperan sebagai komponen utama
penyusun makhluk hidup. Protein membawa kode-kode genetik berupa DNA dan RNA.
Beberapa makanan yang dapat menjadi sumber protein adalah: daging, telur,ikan, susu, biji-
bijian, kentang, kacang, dan polong-polongan. Protein merupakan polimeralam yang tersusun
dari asam-asam amino melalui ikatan peptida, sehingga protein juga disebut
sebagai polipeptida. Di dalam tubuh kita protein berfungsi sebagai zat pembangun, pengatur
pertahanan, dan sebagai sumber energi setelah karbohidrat dan lemak.
Protein dapat digolongkan berdasarkan strukturnya, bentuknya, dan fungsinya.
Struktur Protein
Protein merupakan polipeptida yaitu hasil dari kondensasi dua molekul asam amino. Asam
amino mengandung gugus amino (-NH2) dan karboksil (-COOH). Gugus karboksil bersifat
asam karena dapat melepas proton (H+), sedangkan gugus amino bersifat basa karena dapat
mengikat proton (H+) membentuk NH3+. Oleh karena itu, asam amino bersifat amfoter.
Dalam larutan asam amino membentukion zwitter (bermuatan ganda).
Denaturasi Protein
Denaturasi protein merupakan perubahan struktur protein akibat pengaruh
dari perubahan suhu, perubahan pH, radiasi, deterjen, dan perubahan jenis pelarut. Protein
yang terdenaturasi hamper selalu mengalami kehilangan fungsi biologis. Hal ini paling mudah
diperlihatkan oleh sifat protein. Jika larutan protein secara perlahan-lahan
dipanaskan sampai kira-kira 60 atau 70oC, larutan tersebut lambat laun akan menjadi keruh
dan membentuk koagulasi berbentuk seperti tali. Produk yang terjadi tidak akan melarut lagi
dengan pendinginan dan tidak membentuk larutan jernih seperti semula sebelum dipanaskan.
Pengaruh panas terjadi pada semua protein globular, tanpa memandang ukuran atau fungsi
biologinya, walaupun suhu yang tepat bagi fenomena ini mungkin bervariasi . Protein dalam
keadaan alamiahnya disebut protein asli (natif);setelah perubahan menjadi protein
terdenaturasi. Denaturasi protein dapat diakibatkan bukan hanya oleh panas, tetapi juga pH
ekstrim; oleh beberapa pelarut organic seperti alcohol atau aseton; oleh zat terlarut tertentu
seperti urea; oleh detergen; atau hanya dengan pengguncangan intensif larutan protein dan
bersingungan dengan udara sehingga berbentuk busa. Denaturasi protein merupakan suatu
proses dimana terjadi perubahan atau modifikasi terhadap konformasi protein, lebih tepatnya
terjadi pada struktur tersiermaupun kuartener dari protein. Pada struktur tersier protein
misalnya, terdapat
empat jenis interaksi pada rantai samping seperti ikatan hidrogen, jembatan garam, ikatan
disulfida, interaksinon polar pada bagian non hidrofobik. Adapun penyebab daridenaturasi
protein bisa berbagai macam, antara lain panas, alkohol, asam-basa, maupun logam berat. Ciri-
ciri suatu protein yang mengalami denaturasi bisa dilihat dari berbagai hal. Salah satunya
adalah dari perubahan struktur fisiknya, protein yang terdenaturasi biasanya
mengalami pembukaan lipatan pada bagian-bagian tertentu. Selain itu, protein yang
terdenaturasi akan berkurang kelarutannya. Lapisan molekul yang bagian hidrofobik akan
mengalami perubahan posisi dari dalam ke luar, begitupun sebaliknya. Hal ini akan membuat
perubahan kelarutan. Selain itu, masing-masing penyebab denaturasi protein juga
mengakibatkan ciri denaturasi yang spesifik. Panas, misalnya. Panas dapat mengacaukan
ikatan hidrogendari protein namun tidak akan mengganggu ikatan kovalennya. Hal ini
dikarenakan dengan meningkatnya suhu akan membuat energi kinetik molekul bertambah.
Bertambahnya energi kinetik molekul akan mengacaukan ikatan-ikatan hidrogen. Dengan
naiknya suhu, akan membuat perubahan entalpi sistem naik. Selain itu
bentuk protein yang terdenaturasi dan tidak teratur juga sebagai tanda bahwa entropi bertamb
ah. Entropi sendiri merupakan derajat ketidakteraturan, semakin tidak teratu rmaka entropi
akan bertambah. Pemanasan juga dapat mengakibatkan kemampuan protein untuk mengikat
air menurun dan menyebabkan terjadinya koagulasi. Selain oleh panas, asam dan basa juga
dapat membuat protein terdenaturasi. Seperti telah diketahui bahwa protein dapat membentuk
struktur
zwitterion. Protein juga memiliki titik isoelektrik dimana jumlah muatan positif dan muatan n
egatif pada protein adalah sama. Pada saat itulah, protein dapat terdenaturasi yang
ditandai dengan membentuk gumpalan dan larutannya menjadi keruh. Pada saat ini entalpi
pelarutannya akan menjadi tinggi, karena jumlah kalor yang dibutuhkan untuk melarutkan
sejumlah protein akan bertambah. Mekanismenya adalah penambahan asam dan basa dapat
mengacaukan jembatan garam yang terdapat pada protein. Ion positif dan negatif pada garam
dapat berganti pasangan dengan ion positif dan negatif dari asam ataupun basa sehingga
jembatan garam pada protein yang merupakan salah satu jenis interaksi pada protein, menjadi
kacau dan protein dapat dikatakan terdenaturasi. Bentuk protein terdenaturasi yang mengendap
ini juga dapat diakibatkan oleh pengaruh logam-logam berat. Dengan adanya logam-
logam berat itu akan terbentuk kompleks garam protein-logam. Kompleks inilah yang
membuat protein akan sulituntuk larut. Dan sama dengan ketika protein terdenaturasi akibat
asam dan basa,
entalpi pelarutannya akan naik. Protein bermuatan negatif atau protein dengan pH larutan
diatas titik isoelektrik akan diendapkan oleh ion positif atau logam lebih mudah. Sebaliknya,
protein bermuatan positif dengan pH larutan di bawah titik isoelektrik membutuhkan ion-ion
negatif. Contoh ion-ion positif yang dapat mengendapkan protein misalnya
Ag+, Ca2+, Zn2+, Hg2+, Fe2+, Cu2+, dan Pb2+. Dan contoh ion-ion negatif yang dapat
mengendapkan protein misalnya ion salisilat, trikloroasetat, piktrat, tanat, dan sulfosalisilat.
Namun selain membentuk kompleks garam protein-logam yang sukar larut, logam berat dapat
menarik sulfur pada protein sehingga mengganggu ikatan disulfida dalam protein dan
menyebabkan protein terdenaturasi pula. Gangguan pada ikatan disulfida selain disebabkan
oleh logam berat juga dapatdisebabkan oleh agen-agen pereduksi. Agen pereduksi ini bisa
menyebabkan ikatandisulfida putus dan dapat membentuk gugus tiol (-SH) dengan
penambahan atomhidrogen. Selain ikatan disulfida, ikatan lain yang apabila terganggu dapat
menyebabkan denaturasi protein adalah ikatan hidrogen. Dengan adanya alkohol dapat
merusak ikatan hidrogen antar rantai samping dalam struktur tersier suatu protein. Selain itu,
alkohol juga dapat mendenaturasi protein. Alkohol seperti kita ketahui umumnya terdapat
kadar 70% dan 95%. Alkohol 70% bisa masuk ke dindingsel dan dapat mendenaturasi protein
di dalam sel. Sedangkan alkohol 95% mengkoagulasikan protein di luar dinding sel dan
mencegah alkohol lain masuk kedalam sel melalui dinding sel. Sehingga yang digunakan
sebagai disinfektan adalah alkohol 70%. Alkohol mendenaturasi protein dengan memutuskan
ikatan hidrogen intramolekul pada rantai samping protein. Ikatan hidrogen yang baru dapat
terbentuk antara alkohol dan rantai samping protein tersebut. Dalam pandangan klasik
mengenai dua kondisi pelipatan protein, sebuah protein dikatakan berada dalam kondisi
kesetimbangan dinamis antara suatu kondisi terlipat (folded state) yang kompak dengan energi
dan entropi rendah serta suatu kondisi entropi tinggi yang secara struktural ditandai dengan
konformasi tidak teratur berenergi tinggiyang dikenal juga sebagai kondisi tidak terlipat
(unfolded state). Kemudian seperti telah dibahas sebelumnya bahwa proses perubahan dari
folded ke unfolded berjalan reversibel namun sangat lambat berarti memungkinkan
terjadi proses renaturasi. Proses renaturasi atau pengembalian struktur dari struktur proteinter
denaturasi menjadi struktur protein awal bisa saja terjadi. Namun, perlu diingatapabila struktur
protein awal terlalu kompleks, maka proses renaturasi atau refolding tersebut akan berlangsung
sangat lambat dan sulit. Contohnya seperti pada protein yangterdapat pada telur. Apabila
protein tersebut telah terdenaturasi, maka akan sulit untukmengembalikan ke kondisi
naturalnya.
Anda mungkin juga menyukai
- TerrariumDokumen6 halamanTerrariumDewi Kusuma NingtyasBelum ada peringkat
- Sistem DispersiDokumen12 halamanSistem DispersiRiky PramudyaBelum ada peringkat
- Laporan 2 Pembuatan LarutanDokumen17 halamanLaporan 2 Pembuatan LarutanReynold Kevin0% (2)
- MASSA JENIS FIX Kelompok 2Dokumen9 halamanMASSA JENIS FIX Kelompok 2Renny Dwi AnggraeniBelum ada peringkat
- KaseinDokumen3 halamanKaseinWening OkBelum ada peringkat
- SINGKAT]Sistem Dispersi PanganDokumen10 halamanSINGKAT]Sistem Dispersi Panganrahmi zahidaBelum ada peringkat
- Analisis SusuDokumen10 halamanAnalisis SusuDudi Fathul JawadBelum ada peringkat
- PRINSIP PENGDokumen13 halamanPRINSIP PENGNandika Kasaru JackBelum ada peringkat
- Uji SelivanoffDokumen2 halamanUji SelivanoffSovia RosalinaBelum ada peringkat
- Analisa Gula PereduksiDokumen14 halamanAnalisa Gula PereduksinrahmarBelum ada peringkat
- 2802-Article Text-7061-1-10-20210823Dokumen4 halaman2802-Article Text-7061-1-10-20210823Vio GianBelum ada peringkat
- Pengenalan Karakteristik Biomolekul Pada Karbohidrat Dan LemakDokumen11 halamanPengenalan Karakteristik Biomolekul Pada Karbohidrat Dan LemakAngela RadityatamaBelum ada peringkat
- Sistem DispersiDokumen14 halamanSistem DispersiAnonymous JXKgWBjerBelum ada peringkat
- Biokimia Uji LipidDokumen15 halamanBiokimia Uji LipiduesBelum ada peringkat
- Bab 7 Laporan Analisa Kadar Mineral FeDokumen7 halamanBab 7 Laporan Analisa Kadar Mineral FeipinseraBelum ada peringkat
- LAPORAN SUSUDokumen8 halamanLAPORAN SUSUAzzahra Nadya PutriBelum ada peringkat
- Kelompok 7 - Modul 1Dokumen22 halamanKelompok 7 - Modul 1Ziyad AslamBelum ada peringkat
- Makalah Kimia Pangan (Air)Dokumen23 halamanMakalah Kimia Pangan (Air)Anita Diva Sylvia100% (4)
- Analisis Lemak Tugas Praktikum Ilmu PGHTDokumen6 halamanAnalisis Lemak Tugas Praktikum Ilmu PGHTAlfikri AshidiqiBelum ada peringkat
- PEMBAHASAN KULTUR MIKROORGANISMEDokumen8 halamanPEMBAHASAN KULTUR MIKROORGANISMEVini FitrianiBelum ada peringkat
- Laporan Praktikum 3 Biokimia - ProteinDokumen18 halamanLaporan Praktikum 3 Biokimia - ProteinHadi WijayaBelum ada peringkat
- Enzim LipaseDokumen37 halamanEnzim LipaseBAHRUNBelum ada peringkat
- Laporan Praktikum Kimia Pertanian 5Dokumen7 halamanLaporan Praktikum Kimia Pertanian 5Rizki Arifani 'IkiBelum ada peringkat
- REAKSI BROWNING PADA KARBOHIDRATDokumen11 halamanREAKSI BROWNING PADA KARBOHIDRATbelawahyuBelum ada peringkat
- Uji Protein, Karbohidrat, Vitamin, Enzim dan LipidDokumen99 halamanUji Protein, Karbohidrat, Vitamin, Enzim dan LipidK-NndafBelum ada peringkat
- Struktur Dan Fungsi MembranDokumen12 halamanStruktur Dan Fungsi MembranNurul MentariBelum ada peringkat
- Kelarutan ProteinDokumen8 halamanKelarutan ProteinNina Asriana AndiBelum ada peringkat
- Emulsi dan KestabilannyaDokumen15 halamanEmulsi dan KestabilannyaRifa AlfiaBelum ada peringkat
- Pembahasan NinhidrinDokumen2 halamanPembahasan NinhidrinAgungBelum ada peringkat
- ENZIMPAPAINDANBROMELINDokumen10 halamanENZIMPAPAINDANBROMELINJasmine Chandra Dewi0% (1)
- Kelompok 9 - LAPORAN ACARA 3Dokumen12 halamanKelompok 9 - LAPORAN ACARA 3Elsa simanjuntakBelum ada peringkat
- Tujuan + Prinsip DispersiDokumen1 halamanTujuan + Prinsip DispersiRosaria PuspasariBelum ada peringkat
- Pembahasan Fitokimia MaserasiDokumen5 halamanPembahasan Fitokimia Maserasisalsabilla hastuti dwi kustyoriniBelum ada peringkat
- Laporan Tetap SatopDokumen12 halamanLaporan Tetap SatopSilvia Permata BundaBelum ada peringkat
- Uji Protein Dengan BiuretDokumen11 halamanUji Protein Dengan Biuretputu ayu wulandariBelum ada peringkat
- MooreDokumen2 halamanMooreFianti DamayantiBelum ada peringkat
- Pembahasan Buah Dan SayurDokumen6 halamanPembahasan Buah Dan SayurSiti Kania DewiBelum ada peringkat
- Penentuan Gula Pereduksi Dan Pati - Kelompok MDokumen15 halamanPenentuan Gula Pereduksi Dan Pati - Kelompok MSofiarizkyamalia sofiaBelum ada peringkat
- Pengawetan - Pengalengan BuahDokumen12 halamanPengawetan - Pengalengan BuahSophia IPBelum ada peringkat
- Kelompok 1 BiokimiaDokumen7 halamanKelompok 1 BiokimiaandiBelum ada peringkat
- Laporan Praktikum Mengenai Pemeriksaan Glukosa Dan Protein Pada UrineDokumen12 halamanLaporan Praktikum Mengenai Pemeriksaan Glukosa Dan Protein Pada UrineSeptia NurhalizaBelum ada peringkat
- Reaksi Maillard Pada KecapDokumen14 halamanReaksi Maillard Pada KecapgiggaarioBelum ada peringkat
- Makalah Satuan OperasiDokumen14 halamanMakalah Satuan OperasiHasbunallah lessumBelum ada peringkat
- Kinetika EnzimDokumen7 halamanKinetika EnzimCheppy Yogie FloraBelum ada peringkat
- Laporan Praktikum Saayuran Dan UmbiDokumen41 halamanLaporan Praktikum Saayuran Dan Umbironi pasaribuBelum ada peringkat
- Uji Kualitatif Protein I JurnalDokumen9 halamanUji Kualitatif Protein I JurnalZahratul HayatiBelum ada peringkat
- KarbohidratDokumen16 halamanKarbohidratSatria Budi KusumaBelum ada peringkat
- PENGOLAHAN PANGANDokumen5 halamanPENGOLAHAN PANGANAprilia Irena Gunawan100% (1)
- Analisis KarbohidratDokumen25 halamanAnalisis KarbohidratRahma NiarBelum ada peringkat
- MetabolismeLemakDokumen10 halamanMetabolismeLemakHannaTamaraBelum ada peringkat
- Identifikasi Karbohidrat dengan Uji Barfoed, Benedict, Molisch dan SeliwanoffDokumen2 halamanIdentifikasi Karbohidrat dengan Uji Barfoed, Benedict, Molisch dan SeliwanoffSiti RositahBelum ada peringkat
- Laporan Uji SusuDokumen9 halamanLaporan Uji SusuELISHYA AuroraBelum ada peringkat
- SiklusKrebsEnergiDokumen29 halamanSiklusKrebsEnergiDwi Feri HariyantoBelum ada peringkat
- Acara II Penentuan Maa Rumus Zat KimiaDokumen11 halamanAcara II Penentuan Maa Rumus Zat KimiaRahayu Sri RejekiBelum ada peringkat
- Acara 4Dokumen20 halamanAcara 4Ririn BulbulforeverBelum ada peringkat
- Laporan Praktikum PemisahanDokumen20 halamanLaporan Praktikum PemisahanRaihan PristayunaBelum ada peringkat
- GLIKOGENESISDokumen3 halamanGLIKOGENESISsafira muliaBelum ada peringkat
- Denaturasi ProteinDokumen4 halamanDenaturasi ProteinAlvaroMorataBelum ada peringkat
- Denaturasi Protein oleh Logam Berat, Panas dan AsamDokumen27 halamanDenaturasi Protein oleh Logam Berat, Panas dan AsamShandy wibowoBelum ada peringkat
- PROTEIN DENATURASIDokumen10 halamanPROTEIN DENATURASIIskandar AididBelum ada peringkat
- Tugas Biokimia Pangan HarsidaDokumen17 halamanTugas Biokimia Pangan HarsidaIjhanzBelum ada peringkat
- Tugas Seni Musik Kelas 8Dokumen6 halamanTugas Seni Musik Kelas 8Dewi Kusuma NingtyasBelum ada peringkat
- LKPD AnimaliaDokumen7 halamanLKPD AnimaliaDewi Kusuma NingtyasBelum ada peringkat
- Sistematika Proposal SkripsiDokumen28 halamanSistematika Proposal SkripsiDewi Kusuma NingtyasBelum ada peringkat
- OPTIMAL UNTUK KOLOIDDokumen4 halamanOPTIMAL UNTUK KOLOIDDewi Kusuma NingtyasBelum ada peringkat
- HasilPengamatanDokumen4 halamanHasilPengamatanDewi Kusuma NingtyasBelum ada peringkat
- Penilaian Seni Musik Lagu Populer Kelas IxDokumen1 halamanPenilaian Seni Musik Lagu Populer Kelas IxDewi Kusuma NingtyasBelum ada peringkat
- Rencana Pelaksanaan Pembelajaran (RPP) : Video Based Learning Dalam Mempelajari Materi ReproduksiDokumen13 halamanRencana Pelaksanaan Pembelajaran (RPP) : Video Based Learning Dalam Mempelajari Materi ReproduksiDewi Kusuma NingtyasBelum ada peringkat
- Laporan Kultur AirDokumen15 halamanLaporan Kultur AirDewi Kusuma NingtyasBelum ada peringkat
- Perkembangan Biji dan FungsinyaDokumen23 halamanPerkembangan Biji dan FungsinyaDewi Kusuma NingtyasBelum ada peringkat
- Bab 2 Sel Bio UmumDokumen43 halamanBab 2 Sel Bio UmumDecyana WahyudinBelum ada peringkat
- 1 - Hasil Pengamatan Akumulasi Hara MineralDokumen2 halaman1 - Hasil Pengamatan Akumulasi Hara MineralDewi Kusuma NingtyasBelum ada peringkat
- Jaringan OtotDokumen38 halamanJaringan OtotDewi Kusuma NingtyasBelum ada peringkat
- Embrio AngiospermaeDokumen1 halamanEmbrio AngiospermaeDewi Kusuma NingtyasBelum ada peringkat
- Laporan Fistum Potensial AirDokumen1 halamanLaporan Fistum Potensial AirDewi Kusuma NingtyasBelum ada peringkat
- APOMIKSISDokumen9 halamanAPOMIKSISDewi Kusuma NingtyasBelum ada peringkat
- AMDALDokumen77 halamanAMDALDewi Kusuma NingtyasBelum ada peringkat
- Hasil Pengamatan Fiswan Peredaran DarahDokumen2 halamanHasil Pengamatan Fiswan Peredaran DarahDewi Kusuma NingtyasBelum ada peringkat
- Panitia Peringatan Hari Besar NasionalDokumen1 halamanPanitia Peringatan Hari Besar NasionalDewi Kusuma NingtyasBelum ada peringkat
- Konsep Pembangunan BerkelanjutanDokumen5 halamanKonsep Pembangunan BerkelanjutanDewi Kusuma NingtyasBelum ada peringkat
- Laporan Fistum Potensial AirDokumen12 halamanLaporan Fistum Potensial AirDewi Kusuma NingtyasBelum ada peringkat
- Teori Bag TyasDokumen4 halamanTeori Bag TyasDewi Kusuma NingtyasBelum ada peringkat
- Konsep Pembangunan BerkelanjutanDokumen20 halamanKonsep Pembangunan BerkelanjutanDewi Kusuma NingtyasBelum ada peringkat
- Daun Majemuk BerselingDokumen7 halamanDaun Majemuk BerselingDewi Kusuma NingtyasBelum ada peringkat
- Udara Tanah Dan Aerasi TanahDokumen115 halamanUdara Tanah Dan Aerasi TanahDewi Kusuma NingtyasBelum ada peringkat
- 12.teknik PenulisanDokumen15 halaman12.teknik PenulisanFeni Utari BasyarBelum ada peringkat
- Surat Pak YodDokumen3 halamanSurat Pak YodDewi Kusuma NingtyasBelum ada peringkat
- HasilPengamatanDokumen4 halamanHasilPengamatanDewi Kusuma NingtyasBelum ada peringkat
- 36 en IdDokumen20 halaman36 en IdDewi Kusuma NingtyasBelum ada peringkat
- 2018-Petunjuk Praktikum IthDokumen52 halaman2018-Petunjuk Praktikum IthDewi Kusuma Ningtyas100% (1)





![SINGKAT]Sistem Dispersi Pangan](https://imgv2-1-f.scribdassets.com/img/document/528868408/149x198/667599de42/1633072036?v=1)