149 412 2 PB
Diunggah oleh
xwranJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
149 412 2 PB
Diunggah oleh
xwranHak Cipta:
Format Tersedia
Profil Protein Spermatozoa Setelah Pembekuan
M. Dwi Susan1), Sri Rahayu1)
1) Laboratorium Biomolekuler dan Seluler, Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam,
Universits Brawijaya, Malang 65145, JawaTimur, Indonesia. E-mail: dwi.susan1990@gmail.com
ABSTRAK
Tujuan penelitian ini adalah untuk mengetahui profil protein spermatozoa sebelum dan setelah
pembekuan. Protein spermatozoa diisolasi dari 10 sampel sapi Friesian holstein dengan pemisahan
fraksi atas dan bawah hasil sentrifugasi. Profil protein kemudian dianalisis menggunakan SDS PAGE
dengan konsentrasi separating gel 12,5%. Data yang diperoleh dianalisis secara deskriptif dengan
membandingkan profil protein spermatozoa sebelum dan setelah pembekuan. Hasil analisis
menunjukkan bahwa pada fraksi atas semen segar ditemukan 12 pita protein spermatozoa dengan berat
molekul 144, 128, 99, 90, 83, 59, 31, 20, 14, 12, 10 dan 9 kDa, dan pada semen beku ditemukan 8 pita
protein spermatozoa dengan berat molekul 144, 128, 99, 90, 83, 59, 31, 14 dan 12 kDa. Sementara itu
pada fraksi bawah semen segar ditemukan 16 pita protein dengan berat molekul 128, 116, 103, 90, 75,
69, 48, 40, 31, 26, 20, 14, 10, 9, 7 dan 6 kDa, dan 11 pita protein dengan berat molekul 128, 116, 103,
90, 75, 69, 48, 40, 31, 20 dan 14 kDa pada semen beku. Dari penelitian yang telah dilakukan dapat
disimpulka bahwa terdapat perbedaan profil protein spermatozoa sebelum dan setelah pembekuan
yang dilihat dari variasi berat molekul protein pada masing – masing perlakuan.
kata kunci : pembekuan, protein, SDS PAGE, spermatozoa.
ABSTRACT
The aims of this research was to determine protein profile of spermatozoa before and after freezing.
Spermatozoa proteins was isolated from 10 sample Friesian holstein using separate upper and lower
fraction of sentrifugation result. Protein profiles was analysed by SDS PAGE with separating gel
12,5%. Data was analyzed descriptively by comparing of spermatozoa protein profiles of before and
after freezing. The result showed in upper fraction of fresh semen found 12 protein bands with
moleculer weight of 144, 128, 99, 90, 83, 59, 31, 20, 14, 12, 10, 9 kDa and frozen semen found 8
protein bands with moleculer weight of 144, 128, 99, 90, 83, 59, 31, 14, 12 kDa. In the lower fraction
of fresh semen found 16 protein bands with molecular weight of 128, 116, 103, 90, 75, 69, 48, 40, 31,
26, 20, 14, 10, 9, 7, 6 kDa, and 11 protein bands with molecular weights of 128, 116, 103, 90, 75, 69,
48, 40, 31, 20 14 kDa in frozen semen. In conclusion, there were differences protein profiles of
spermatozoa before and after freezing semen are seen from variation of moleculer weight protein on
each treatments.
key words : protein, SDS PAGE, spermatozoa.
PENDAHULUAN (Tanaka et al, 2000), peningkatan abnormalitas
dan penurunan viabilitas sebesar 20-30%
Bioteknologi yang bisa digunakan untuk (Dhanju et al, 2001), penurunan integritas
meningkatkan populasi sapi dalam negeri adalah membran plasma (Nishizono et al, 2000),
inseminasi buatan (IB). IB dilapangan banyak peningkatan kesalahan kondensasi kromatin, dan
menggunakan semen beku hasil pembekuan peningkatan fragmentasi DNA (Yildiz et al,
dengan pertimbangan masa simpan lebih lama 2007). Adanya penurunan kualitas spermatozoa
dan pelaksanaannya lebih mudah dibandingkan akan mengakibatkan penurunan kemampuan
dengan semen segar. Namun pada beberapa fertilisasi spermatozoa (Zilli, 2005).
kasus, pembekuan dan thawing dapat Penurunan kualitas spermatozoa selama
menginduksi kerusakan spermatozoa yang pembekuan dan thawing salah satunya
berakibat pada penurunan kualitas (Zilli et al, disebabkan oleh peningkatan kadar reactive
2005) seperti penurunan motilitas sebesar 40% oxygen species (ROS). Hasil produk ROS seperti
Jurnal Biotropika | Vol. 1 No. 4 | 2013 166
Peroksida lipid akan merusak struktur dan fungsi lalu ditambahkan PBS hangat pH 7,4 pada
membran dengan mengacaukan struktur masing – masing fraksi. Suspensi disentrifugasi
fosfolipid dan fluiditas membran (Atiken, 1995). pada kecepatan 10.000 rpm selama 10 menit.
Peningkatan Ca2+ ekstra dan intraseluler dan Diambil pelet dan ditambahkan PBS hangat pH
adanya peroksida lipid pada membran fosfolipid 7,4, lalu disentrifugasi kembali pada kecepatan
akhirnya akan mengubah struktur dan 10.000 rpm selama 10 menit. Diambil pelet dan
terdegradasinya membran (Awda, 2009). ditambahkan buffer ekstrak protein yang
Terdegradasinya membrane menyebabkan mengandung 1M Tris Cl-pH 6,8, 5M NaCl, 10%
kerusakan komponen sel yang penting seperti sodium deoxycholate, 20% SDS dan ddH2O.
DNA dan protein. Hasil akhir adalah isolat crude protein yang
Kerusakan DNA oleh peroksida lipid disimpan pada suhu -20°C sampai akan
seperti pembukaan cincin, fragmentasi dan cross dilakukan elektroforesis. Untuk mengetahi
linking protein-DNA dan pemecahan untai DNA konsentrasi protein total setiap isolat dilakukan
akan menyebabkan sel mengalami mutasi atau uji kuantitatif menggunakan spektofotometri.
letal (Awda, 2009). Selain itu, hasil peroksidasi
lipid seperti malondialdehyde (MDA) dan 4- Analisis profil protein
hydroxynonenol juga memicu terjadinya
modifikasi oksidasi protein yang dapat merusak Profil protein spermatozoa dianalisis
enzim active sites, merusak konformasi menggunakan SDS PAGE dengan konsentrasi
struktural protein dan menyebabkan protein tidak separating gel 12,5% dan stacking gel 5%.
folding atau kesalahan folding untuk membentuk Running sampel dilakukan pada arus konstan 30
struktur aslinya (Kumar et al, 2010). mA selama kurang lebih 60 menit. Gel hasil
Adanya perubahan atau hilangnya running diwarnai menggunakan Commasie
susunan protein selama pembekua tentunya akan Brilliant Blue sampai pita protein terlihat jelas.
mengakibatkan perubahan aktifitas fungsional
protein (Lessard et al, 2000). Salah satu contoh Analisis data
fungsi penting protein spermatozoa adalah
sebagai ligan untuk pengenalan dengan ZP3 yang Data yang diperoleh dianalisis secara
merupakan glikoprotein pada zona pelusida deskriptif dengan membandingkan profil protein
(Morales, 1996). Mempertimbangkan hal itu hasil SDS PAGE sebelum dan setelah
maka penelitain dengan tujuan untuk mengetahui pembekuan
profil protein spermatozoa sebelum dan setelah
pembekuan ini penting untuk dilakukan. HASIL DAN PEMBAHASAN
METODE PENELITIAN Analisis profil protein spermatozoa
Sampel penelitian Berdasarkan hasil elektroforesis dapat
diketahui perbedaan profil protein spermatozoa
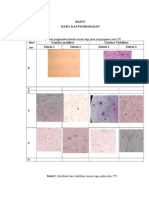
Sampel yang digunakan pada penelitian pada fraksi atas semen segar dan beku (gambar 1
ini adalah 5 semen segar dan beku sapi Friesian dan tabel 1)
Holstein yang dikoleksi dari Balai Besar
Insemniansi Buatan Singosari Malang. Semen M 1 2 3 4 5 6 7 8 9 10
segar yang digunakan memiliki motilitas masa
260 kDa
++ dan motilitas individu >70%. Semen beku
yang digunakan adalah semen beku yang telah 70 kDa
disimpan selama 1 bulan. 40 kDa
Isolasi protein spermatoza 25 kDa
Metode isolasi protein spermatozoa yang 10 kDa
digunakan pada penelitian ini berdasarkan
Cheema et al (2010). Spematozoa dan seminal
plasma dipisahkan menggunakan PBS hangat pH
7,4 dengan sentrifugasi pada kecepatan 2000 rpm
selama 10 menit. Diambil fraksi atas dan bawah,
Jurnal Biotropika | Vol. 1 No. 4 | 2013 167
Gambar 1. hasil elektroforesis protein Gambar 2. hasil elektroforesis SDS PAGE
spermatozoa fraksi atas. M adalah marker protein spermatozoa fraksi bawah. M adalah
protein dengan berat molekul 260-10 kDa. Lane marker protein dengan berat molekul 260-10
1-5 adalah isolat crude protein dari 5 semen kDa. Lane 1-5 adalah isolat crude protein semen
segar. Lane 6-10 adalah isolat crude protein dari segar. lane 6-10 adalah isolat crude protein
5 semen beku. semen beku.
Tabel 1. variasi berat molekul protein Tabel 2. variasi berat molekul protein
spermatozoa fraksi atas (kDa) spermatozoa fraksi bawah (kDa)
Pita protein Fraksi atas Pita Fraksi bawah
Segar Beku protein Segar Beku
1 2 3 4 5 6 7 8 9 10 1 2 3 4 5 6 7 8 9 10
144kDa . . . . . . . . . . 128kDa . . . . . . . . . .
128kDa . . . . . . . . . . 116kDa . . . . . . . . . .
99kDa . . . . . . . . . . 103kDa . . . . . . . . . .
90kDa . . . . . . . . . . 90kDa . . . . . . . . . .
83 kDa . . . . . . . . . . 75 kDa . . . . . . . . . .
59 kDa . . . . . . . . . . 69 kDa . . . . . . . . . .
31 kDa . . . . . . . . . . 48 kDa . . . . . . . . . .
20 kDa . . . . . - - - - - 40 kDa . . . . . . . . . .
14 kDa . . . . . . . . . . 31 kDa . . . . . . . . . .
12 kDa . . . . . . . . . . 26 kDa . . . . . - - - - -
10 kDa . . . . . - - - - - 20 kDa . . . . . . . . . .
9 kDa . . . . . - - - - - 14 kDa . . . . . . . . . .
10 kDa . . . . . - - - - -
Keterangan : 9 kDa . . . . . - - - - -
. Ada pita protein 7 kDa . . . . . - - - - -
- Tidak ada pita protein 6 kDa . . . . . - - - - -
Hasil elektroforesis semen segar Keterangan :
ditemukan 12 pita protein spermatozoa dengan . Ada pita protein
berat molekul 144, 128, 99, 90, 83, 59, 31, 20, - Tidak ada pita protein
14, 12, 10 dan 9 kDa. Sedangkan pada semen
beku ditemukan 9 pita protein dengan berat Perbedaan profil protein dapat dilihat
molekul 144, 128, 99, 90, 83, 59, 31, 14 dan 12 berdasarkan keberadaan pita – pita protein dan
kDa. Pada hasil analisis semen beku tidak variasi berat molekul protein. Hasil elektroforesis
ditemukan 3 pita protein dengan berat molekul semen segar ditemukan 16 pita protein dengan
20, 10 dan 9 kDa yang ditemukan pada semua berat molekul 128, 116, 103, 90, 75, 69, 48, 40,
semen segar. 31, 26, 20, 14, 10, 9, 7 dan 6 kDa. Sedangkan
Hasil elektroforesis fraksi bawah pada semen beku ditemukan 11 pita protein
(gambar 2 dan tabel 2) juga dapat diketahui dengan berat molekul 128, 116, 103, 90, 75, 69,
adanya perbedaan profil protein antara semen 48, 40, 31, 20 dan 14 kDa. Ada 5 pita protein
segar dan beku dengan berat molekul 26, 10, 9, 7 dan 6 kDa
yang ditemukan pada semua semen segar tidak
ditemukan pada semua semen beku.
M 1 2 3 4 5 6 7 8 9 10 Penelitian yang dilakukan Ollero et al
260 kDa (1998) menggunakan sampel sapi menunjukkan
bahwa ada perbedaan profil protein spermatozoa
70 kDa
antara semen segar dan beku hasil pembekuan.
40 kDa Ada 4 pita protein dengan berat molekul 245,
100, 68, dan 35 kDa yang tidak terdeteksi pada
25 kDa semen beku. Tidak terdeteksinya pita protein
dikarenakan telah hilang selama proses
pembekuan. Adanya perbedaan berat molekul
10 kDa yang ditemukan pada penelitian ini dengan
Jurnal Biotropika | Vol. 1 No. 4 | 2013 168
penelitian yang dilakukan Ollero dimungkinkan Dari gambar 1 dan 2 juga dapat
karena pemilihan bangsa sapi dan parameter diketahui bahwa terdapat perbedaan jumlah dan
waktu pembekuan yang digunakan pada variasi berat molekul pita protein pada fraksi atas
penelitian ini berbeda dengan penelitian Ollero et dan bawah. Pada fraksi atas ditemukan lebih
al. sedikit pita protein daripada fraksi bawah, dan
Hilangnya protein spermatozoa selama berat molekul protein pada kedua fraksi tidak
pembekuan disebabkan oleh banyak faktor. Salah sama meskipun ada bebrapa protein dengan berat
satunya adalah adanya peningkatan kadar ROS molekul sama yang muncul. Adanya perbedaan
selama pembekuan (Awda, 2009). Terjadinya jumlah pita protein antara fraksi atas dan bawah,
peningkatan ROS pada pembekuan disebabkan dimungkinkan karena ada beberapa pita protein
karena habisnya atau kurangnya antioksidan seminal plasma yang ikut terdeteksi dalam fraksi
yang tersedia pada spermatozoa tidak mampu bawah.
mengubah oksigen reaktif (O) menjadi senyawa Pencucian spermatozoa dari seminal
yang netral (O2) karena adanya stres oksidasi plasma bisa dilakukan menggunakan
pada proses oksidasi fosforilasi. Rendahnya sentrifugasi. Hasil swim up akan terbentuk
produksi O2 menginduksi terjadinya peroksida beberapa medium. Spermatozoa yang hidup atau
lipid (Lamirande et al, 1997). Peroksida lipid yang masih aktif bergerak akan menuju keatas
akan merusak struktur dan fungsi membran media sedangkan spermatozoa yang mati,
dengan mengacaukan struktur fosfolipid dan berbagai macam mikroorganisme, dan debris sel
fluiditas membran (Atiken, 1995). Peningkatan akan bergerak dan mengendap kebawah media
ekstra dan intraseluler Ca2+ dan peroksida lipid (Jamel, 2008).
pada membran fosfolipid akhirnya akan Semua sampel fraksi atas dan bawah
mengubah struktur dan degradasi membran baik pada semen segar dan beku ditemukan 4
(Awda, 2009). Degradasi membrane akan pita protein dengan berat molekul yang sama,
menyebabkan terdegradasinya komponen sel yaitu 128, 90, 31 dan 14 kDa. Pita protein
yang penting seperti protein dan DNA. Protein dengan berat molekul 90 kDa didentifikasi
yang telah terdegradasi oleh produk ROS akan sebagai heat shock protein 90 (HSP-90) yang
dengan mudah berpindah ke medium memiliki peran penting terhadap toleransi stress
ekstraselluler karena membrane sel yang telah serta mengaktifkan nitric oxide synthase (NOS)
rusak (Zilli et al, 2005). yang bermanfaat untuk membantu motilitas
Pembekuan semen yang mengakibatkan spermatozoa. Semakin tinggi ekspresi HSP-90
terdegradasinya beberapa molekul protein maka semakin tinggi pula motilitas dan
spermatozoa akan berkorelasiterhadap penurunan ketahanan spermatozoa terhadap stress akibat
kualitas spermatozoa, seperti penurunan motilitas pembekuan dan thawing (Cao et al, 2003).
sebesar 40% (Tanaka et al , 2000), peningkatan Protein dengan berat molekul 31 kDa
abnormalitas, penurunan viabilitas sebesar 20- didentifikasi sebagai Heparin Binding Protein 30
30% (Dhanju et al, 2001) dan penurunan (HBP-30) dengan nama Fertility Associated
kemampuan kapasitasi saat fertilisasi (Nandre, Antigen (FAA). Fungsi protein tersebut untuk
2013). Penelitian yang dilakukan oleh Zilli et al meningkatkan angka kebuntingan sapi sebesar
(2005) menghasilkan bahwa terjadi penurunan 16-19% (Lenz et al, 2000).
tingkat penetasan ikan yang dibuahi dengan
spermatozoa hasil pembekuan. KESIMPULAN
Dari gambar 1 dan 2 hasil elektroforesis
diketahui terdapat perbedaan tebal dan tipisnya Dari penelitian yang telah dilakukan
pita protein. Secara keseluruhan pita protein dapat disimpulkan bahwa terdapat perbedaan
semen segar terlihat lebih tebal dibandingkan profil protein spermatozoa sebelum dan setelah
dengan pita protein semen beku. Adanya pembekuan yang dilihat dari variasi berat
perbedaan tebal tipisnya pita protein dipengaruhi molekulnya. Setelah pembekuan semen, pada
oleh konsentrasi total protein pada masing – fraksi atas tidak ditemukan protein dengan berat
masing sampel. Semakin tinggi konsentrasi total molekul 20, 10 dan 9 kDa dan pada fraksi bawah
protein maka pita yang tercetak dalam gel akan tidak ditemukan protein dengan berat molekul
semakin tebal, begitu juga semakin rendah 26, 10, 9, 7 dan 6 kDa.
konsentrasi total protein maka pita yang tercetak
dalam gel akansemakin tipis.
Jurnal Biotropika | Vol. 1 No. 4 | 2013 169
UCAPAN TERIMA KASIH sperm physiology. Journal Review
Reproduction. 2:48–54
Terima kasih kepada pihak Balai Besar [10] Lessard C, S Parent, P Leclerc, JL Bailey,
Inseminasi Buatan yang telah memberikan izin and R Sullivan. 2000. Cryopreservation
melakukan koleksi semen, dan seluruh staff Alters the Levels of the Bull Sperm Surface
Laboratorium Biologi Molekuler dan Seluler Protein P25b. Journal Androl. 21:700-707
Jurusan Biologi Fakultas Matematika dan Ilmu [11] Ollero, M, O. Bescos, J.A Cebrian-Perez
Pengetahuan Alam Universitas Brawijaya atas and T. Muino-Blanco. 1998. Loss of Plasma
bantuannya selama penelitian ini berlangsung. Membran Protein of Bull Spermatozoa
Through The Freezing-Thawing Process.
DAFTAR PUSTAKA Journal Theriogenology Elsevier. 49:547-
555
[1] Aitken RJ. 1995. Free Radicals, Lipid [12] Nandre, R.M, Fatima, Sh, Bhupal G,
Peroxidation and Sperm Function. Derashri H.J and Joshi, C.G. 2013.
ReprodFertil Dev.7:659–668. Assessment of variations in Indian Bubalus
[2] Awda, Basim J, Meghan Mackenzie-Bell, bubalis seminal plasma proteins during
and Marry M. Buhr. 2009. Reactive Oxygen winter and summer seasons. Iranian Journal
Species and Boar Sper Function. Journal of Veterinary Research. 14:1-8
Biolreprod. 81:553 – 561. [13] Nishizono H, Shioda M, Takeo T, Irie T and
[3] Cao, Wen-Lei, Yi-Xing Wang, Zu-Qiong Nakagata N. 2004. Decrease of Fertilizing
Xiang, and Zheng Li. 2003. Ability of Mouse Spermatozoa After
Cryopreservation-induced decrease in heat- Freezing And Thawing Is Related To
shock protein 90 in human spermatozoa and Cellular Injury. Biology of Reproduction
its mechanism. Asian Journal Androl. 5:43- 71:973–978.
46 [14] Sudarmadji, S. 1996. Teknik Analisa
[4] Cheema, Ranjna S, Amrit K. Bansal, G.S. Biokimiawi. Edisi Pertama. Liberty.
Bilaspuri, and V. K. Gandotra. 2010. Yogyakarta.
Correlation between the proteins and protein [15]Tanaka H, Herliantien, Herwiyanti E, Lubis
profile(s) of different regions of epididymis OP, Buwono, danPujianto J. 2002The
and their contents in goat buck. Animal Aftercare Technical Cooperation for The
Science Papers and Reports. 29:75-84 Strengthening of Artificial Insemination
[5] Dhanju, C.K, R.S Cheema and S.P Kaur. Center Project. Japan International
2001. Effects of Freezing On Protein and Cooperation Agency. p. 2
Profiles Of Sperm Membrane Extracts and [16] Yildiz, Cengiz, Palma Ottaviani, Napoleon
Seminal Plasma of Buffalo Bulls. Journal of Law, Renise Ayearst, Ling Liu and Colin
Department of Animal Breeding, College of McKerlie. 2007. Effects of
Veterinary Sciences, Punjab Agricultural Cryopreservation On Sperm Quality,
University, Ludhiana, India. Nuclear DNA Integrity, In Vitro
[6] Jameel, Tahir. 2008. Sperm Swim-Up: A Fertilization, And In Vitro Embryo
Simple And Effective Technique Of Semen Development In The Mouse. Biology of
Processing For Intrauterine Insemination. Reproduction. 133:585-595
Journal Pak Med Assoc. 58:71-74 [17] Zilli, Loredana, Roberto Sciavone, Vicenzo
[7] Kumar, Vinay, Abul K Abbas, Nelson Zonno, Rocco Rossanao, Carlo Storelli and
Fausto, Jon C. Aster, and James A. Perkins. Sebastiano Viella. 2005. Effect of
2010. Robbins and Cotran Pathology Basic Cryopreservation on Sea Bass Sperm
of Disease, Professional Edition, 8th. Protein. Journal Biolog of Reproduction.
Saunders Elsevier. Philadelphoa. 72:1262-1267.
[8] Zhang, J. N. Oyarzo, M. E. Bellin, and R. L.
Ax. 2000. Bovine Fertility-Associated
Antigen (FAA) and a Recombinant Segment
of FAA Improve Sperm Function
[9] Lamirande, Eve de Lamirande, Hong Jiang,
Armand Zini, Hideya Kodama and Claude
Gagnon. 1997. Reactive oxygen species and
Jurnal Biotropika | Vol. 1 No. 4 | 2013 170
Anda mungkin juga menyukai
- Laporan Isolasi, Uji Kuantitatif & Kualitatif ProteinDokumen8 halamanLaporan Isolasi, Uji Kuantitatif & Kualitatif ProteinWahyu Budy SetyawanBelum ada peringkat
- C1-6 - LP - Isolasi Protein Dan Elektroforesis SDS-PAGEDokumen24 halamanC1-6 - LP - Isolasi Protein Dan Elektroforesis SDS-PAGEImanda EsaBelum ada peringkat
- Adminbiotropika, Khairatul InsaniDokumen6 halamanAdminbiotropika, Khairatul Insani3129 NashihahBelum ada peringkat
- Laporan Praktikum ElektroforesisDokumen8 halamanLaporan Praktikum ElektroforesisMaulidatul FajriyahBelum ada peringkat
- Sosis-Sds PageDokumen21 halamanSosis-Sds PageBayyinah ArdianBelum ada peringkat
- Pembahasan ProteinDokumen11 halamanPembahasan ProteinAlifa Rizki NPBelum ada peringkat
- Kadar Krioprotektan Gliserol Dan Dimethylsulfoxide Terbaik Pada Pengencer Astaxanthin Fosfat Kuning Telur Bebek Terhadap Kualitas Semen Beku BabiDokumen9 halamanKadar Krioprotektan Gliserol Dan Dimethylsulfoxide Terbaik Pada Pengencer Astaxanthin Fosfat Kuning Telur Bebek Terhadap Kualitas Semen Beku BabiNaura mdBelum ada peringkat
- ArtikelDokumen6 halamanArtikelkiky kurniawatiBelum ada peringkat
- Makalah Seminar PoniatiDokumen14 halamanMakalah Seminar PoniatiSYELA DWI HARTATI 1Belum ada peringkat
- Pembahasan Isolasi ProteinDokumen5 halamanPembahasan Isolasi ProteinNoviAfifahBelum ada peringkat
- Teori Sds PageDokumen26 halamanTeori Sds PageSilvia Aryani100% (1)
- Viabilitas Spermatozoa Ayam Hutan Hijau Dalam Pengencer Posfat Kuning Telur Ditambah Laktosa Pada Penyimpanan 5 CDokumen6 halamanViabilitas Spermatozoa Ayam Hutan Hijau Dalam Pengencer Posfat Kuning Telur Ditambah Laktosa Pada Penyimpanan 5 CMuzBelum ada peringkat
- Laporan P5 - Isolasi DNA Plasmid BagaskaraDokumen10 halamanLaporan P5 - Isolasi DNA Plasmid BagaskaraBagaskaraSatriayudhaBelum ada peringkat
- AldhiYaGanniLAPRAKSDS-PAGEDokumen4 halamanAldhiYaGanniLAPRAKSDS-PAGEmaximalter4Belum ada peringkat
- Review JurnalDokumen14 halamanReview JurnalKim BabuBelum ada peringkat
- Isolasi, Pemurnian, Karakterisasi Protein RekombinanDokumen18 halamanIsolasi, Pemurnian, Karakterisasi Protein Rekombinan-niesSaa CupPiy Miew ZHea-100% (2)
- Pemurnian ProteinDokumen14 halamanPemurnian ProteinqwertymegaBelum ada peringkat
- Ajeng Maharani Putri - 186070100011016Dokumen4 halamanAjeng Maharani Putri - 186070100011016Ajeng Maharani PutriBelum ada peringkat
- Laporan BIOMOL Protein RekombinanDokumen13 halamanLaporan BIOMOL Protein RekombinanHelia DewiBelum ada peringkat
- Review Perbedaan Profil Protein Produk Olahan (Sosis) Daging Sapi Dan Daging Babi Hasil Analisa (SDS-PAGE)Dokumen9 halamanReview Perbedaan Profil Protein Produk Olahan (Sosis) Daging Sapi Dan Daging Babi Hasil Analisa (SDS-PAGE)Gayu Putut GuritnoBelum ada peringkat
- Tugas PendahuluanDokumen6 halamanTugas PendahuluanFitri RahmadaniBelum ada peringkat
- Panduan Praktikum Genetika Bakteri Dalam PraktikDokumen36 halamanPanduan Praktikum Genetika Bakteri Dalam PraktikMikrobiologi 2018ipbBelum ada peringkat
- ElektroforesisDokumen13 halamanElektroforesisSteFunnie YolalandhaBelum ada peringkat
- Case Report Ekspresi Analisis Mutasi FenilketonuriaDokumen13 halamanCase Report Ekspresi Analisis Mutasi FenilketonuriawildapurnamaBelum ada peringkat
- Laporan BioselDokumen16 halamanLaporan BioselalvitakhoridatulBelum ada peringkat
- FaktorPertumbuhanEPO DarbepoetinAlfa A3D 106 NgurahPutraPastiyaDokumen16 halamanFaktorPertumbuhanEPO DarbepoetinAlfa A3D 106 NgurahPutraPastiyaMerry VirgoyaniBelum ada peringkat
- Laporan Praktikum Isolasi DnaDokumen10 halamanLaporan Praktikum Isolasi DnaAnamawarBelum ada peringkat
- Makalah FarmakognosiDokumen9 halamanMakalah FarmakognosiNindya Alfa DichaBelum ada peringkat
- 508 1091 1 SMDokumen11 halaman508 1091 1 SMRizki WahyuBelum ada peringkat
- Tahapan Proses PCRDokumen3 halamanTahapan Proses PCRRinaRastutiBelum ada peringkat
- AbdollahiDokumen17 halamanAbdollahiNadiyah AmaliyahBelum ada peringkat
- Pemurnian ProteinDokumen14 halamanPemurnian ProteinKaizer Gancelot100% (1)
- Bananas Whole and Sliced On White Background PowerPoint Templates WidescreenDokumen22 halamanBananas Whole and Sliced On White Background PowerPoint Templates Widescreenkristina sipayungBelum ada peringkat
- Kualitas Semen Kambing Sapera Yang Dibekukan Dalam Pengencer Tris Kuning Telur Dengan Imbuhan PentoxifyllineDokumen8 halamanKualitas Semen Kambing Sapera Yang Dibekukan Dalam Pengencer Tris Kuning Telur Dengan Imbuhan Pentoxifyllineachmad setiyonoBelum ada peringkat
- Sintesis Protein Pada Prokariot Dan EukariotDokumen31 halamanSintesis Protein Pada Prokariot Dan EukariotNi Komang Puja Pertiwi / 30Belum ada peringkat
- Teknik Isolasi Gen Apoptin Dan Green FluorescentDokumen5 halamanTeknik Isolasi Gen Apoptin Dan Green FluorescentNaufal GiffariBelum ada peringkat
- Translate Jurnal1Dokumen19 halamanTranslate Jurnal1nurul amaliyahBelum ada peringkat
- Karakteristik Protein Dan Asam Amino Daging Sapi Bali Dan WagyuDokumen11 halamanKarakteristik Protein Dan Asam Amino Daging Sapi Bali Dan WagyuwindaBelum ada peringkat
- Elektroforesis 1Dokumen36 halamanElektroforesis 1Mita YuandiniBelum ada peringkat
- Pembahasan Genmol ProteinDokumen3 halamanPembahasan Genmol ProteinZahra Novianty100% (1)
- Motilitas Dan Viabilitas Spermatozoa Sapi Limousin PDFDokumen4 halamanMotilitas Dan Viabilitas Spermatozoa Sapi Limousin PDFNekoNandaPratama100% (1)
- PCR TugaDokumen6 halamanPCR TugaMusdalifah IfahBelum ada peringkat
- Kel 1 PoliakrilamidDokumen11 halamanKel 1 PoliakrilamidAnonymous IeuOvjBzKNBelum ada peringkat
- BAB IV Sperma SapiDokumen5 halamanBAB IV Sperma SapiVivin Alfyana Yulia PratamiBelum ada peringkat
- Laporan ProteinDokumen42 halamanLaporan ProteinAnonymous bOpp8DTFoLBelum ada peringkat
- Isolasi Dan Purifikasi ProteinDokumen24 halamanIsolasi Dan Purifikasi ProteinAgan SoenandarBelum ada peringkat
- FatihDokumen7 halamanFatihHenny ChinBelum ada peringkat
- Perbedaan Profil Protein Produk Olahan SDokumen6 halamanPerbedaan Profil Protein Produk Olahan SDafik A. MasruriBelum ada peringkat
- Fix Laporan Praktikum Biologi Molekuler New EditDokumen15 halamanFix Laporan Praktikum Biologi Molekuler New EditanisaBelum ada peringkat
- Laporan Preparasi KromosomDokumen10 halamanLaporan Preparasi Kromosomasterina wulan sari100% (3)
- Silent SunDokumen7 halamanSilent SunAdi Aryanto MBelum ada peringkat
- BAB IV HASIL DAN PEMBAHASAN - Versi BaruDokumen27 halamanBAB IV HASIL DAN PEMBAHASAN - Versi BaruAndika MaknunBelum ada peringkat
- Krisna Chandra Western Blotting Pmib2016Dokumen17 halamanKrisna Chandra Western Blotting Pmib2016Anditri WeningtyasBelum ada peringkat
- Modul Praktikum Analisis KehalalanDokumen34 halamanModul Praktikum Analisis KehalalanRifha LutvikaBelum ada peringkat
- Buku Masakan untuk Penyembuhan Skoliosis Anda: Jadikan tulang belakang lebih sehat dengan mengatur apa yang anda makan!Dari EverandBuku Masakan untuk Penyembuhan Skoliosis Anda: Jadikan tulang belakang lebih sehat dengan mengatur apa yang anda makan!Penilaian: 3.5 dari 5 bintang3.5/5 (4)
- Pembuatan Tablet Jan12 56 Votes Teori SeDokumen91 halamanPembuatan Tablet Jan12 56 Votes Teori SeMohammad Syultonil IchsanBelum ada peringkat
- Ikan Yang Paling Lucu - Penelusuran GoogleDokumen1 halamanIkan Yang Paling Lucu - Penelusuran GooglexwranBelum ada peringkat
- 242 - UTS MikrobiologiDokumen12 halaman242 - UTS MikrobiologixwranBelum ada peringkat
- Customer Single Request Form - Telkomsel OnlyDokumen3 halamanCustomer Single Request Form - Telkomsel OnlyImam MakrusBelum ada peringkat
- Analisa Instrumentasi PDFDokumen160 halamanAnalisa Instrumentasi PDFchrisBelum ada peringkat
- LaRes Farmako 3.1Dokumen10 halamanLaRes Farmako 3.1hafidhbagusBelum ada peringkat
- 9308 27132 3 PBDokumen7 halaman9308 27132 3 PBikaBelum ada peringkat
- Tablet Salut EnterikDokumen45 halamanTablet Salut EnterikxwranBelum ada peringkat
- 642 955 1 SMDokumen7 halaman642 955 1 SMAnonymous jFvgRDSBelum ada peringkat
- Issn: 2597-8012 Jurnal Medika Udayana, Vol. 9 No.4, April, 2020Dokumen6 halamanIssn: 2597-8012 Jurnal Medika Udayana, Vol. 9 No.4, April, 2020xwranBelum ada peringkat
- Persamaan PerbedaanDokumen2 halamanPersamaan PerbedaanxwranBelum ada peringkat
- Quince SeedsDokumen2 halamanQuince SeedsxwranBelum ada peringkat
- Formula Tablet Salut Enterik Natrium Diklofenak Dengan Bahan Penyalut Kollicoat 30 DDokumen4 halamanFormula Tablet Salut Enterik Natrium Diklofenak Dengan Bahan Penyalut Kollicoat 30 DxwranBelum ada peringkat
- 2658-Article Text-25852-1-10-20200811Dokumen14 halaman2658-Article Text-25852-1-10-20200811andrey setiawanBelum ada peringkat
- 1 PB PDFDokumen7 halaman1 PB PDFyerich septaBelum ada peringkat
- FTSPDokumen13 halamanFTSPRizky PerdanaBelum ada peringkat
- 8 Permasalahan Dalam Pembuatan Sediaan TabletDokumen5 halaman8 Permasalahan Dalam Pembuatan Sediaan TabletismaBelum ada peringkat
- SKRIPSI RIsKI AFANDI 13306141006 FISIKA PDFDokumen148 halamanSKRIPSI RIsKI AFANDI 13306141006 FISIKA PDFKhoir NiecakBelum ada peringkat
- Perbedaan LCMS Dan GCMSDokumen3 halamanPerbedaan LCMS Dan GCMSNabilah Urwatul Wutsqo75% (4)
- Chromatography Fase Terbalik Pada Penetapan KadarDokumen58 halamanChromatography Fase Terbalik Pada Penetapan KadarxwranBelum ada peringkat
- Artikel SehatDokumen8 halamanArtikel SehatbimoBelum ada peringkat
- Laporan UV-VIS Kelompok 3 III B - S1Dokumen18 halamanLaporan UV-VIS Kelompok 3 III B - S1Mentari AdindaBelum ada peringkat
- Sinar UVDokumen5 halamanSinar UVxwranBelum ada peringkat
- 2003 2721 1 PBDokumen6 halaman2003 2721 1 PBsingkong irengBelum ada peringkat
- 2 PBDokumen8 halaman2 PBApt Fitri RosdianaBelum ada peringkat
- 05bab1 Nurrosyidah 10060310089 SKR 2014 PDFDokumen31 halaman05bab1 Nurrosyidah 10060310089 SKR 2014 PDFNurkhalis BintangBelum ada peringkat
- Majalah Majalah Majalah Majalah Indonesian Polymer Journal Indonesian Polymer Journal Indonesian Polymer Journal Indonesian Polymer JournalDokumen22 halamanMajalah Majalah Majalah Majalah Indonesian Polymer Journal Indonesian Polymer Journal Indonesian Polymer Journal Indonesian Polymer JournalAndi Tendri AbengBelum ada peringkat
- Bab IiDokumen25 halamanBab IixwranBelum ada peringkat
- 05bab1 Suci 10060311082 SKR 2015Dokumen22 halaman05bab1 Suci 10060311082 SKR 2015xwranBelum ada peringkat
- 05bab1 Kusumo 10060311162 SKR 2015Dokumen15 halaman05bab1 Kusumo 10060311162 SKR 2015RisnawatiBelum ada peringkat