Bab 11 Sulfonasi
Diunggah oleh
Aisyah HaurainaDeskripsi Asli:
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Bab 11 Sulfonasi
Diunggah oleh
Aisyah HaurainaHak Cipta:
Format Tersedia
BAB XI
SULFONASI & SULFATASI
11.1 Pendahuluan
Sulfonasi adalah reaksi memasukan gugus sulfonic acid (-SO 2OH) atau sulfonil
halida (-SO2Cl) pada senyawa organik sebagai bahan baku.
Gugus tersebut bisa terikat pada atom C membentuk produk sulfonat
RH + SO3 RSO3H (11.1)
RH + H2SO4 RSO3H + H2O (11.2)
RH + ClSO3H RSO3H + HCl (11.3)
Gugus tersebut bisa terikat pada atom N membentuk produk N- sulfonat/
sulfamates (RNHSO2ONa)
Sulfatasi adalah reaksi memasukkan gugus –OSO2OH pada atom membentuk
acid sulfate (ROSO2OH), atau memasukkan gugus –SO4-antara dua atom C
membentuk R-OSO2OR
(CH3)2O + SO3 (CH3)2SO4 (11.4)
dimetil eter dimetil sulfate
ROH + ClSO3H ROSO2OH + HCl (11.5)
Alkohol alkohol sulfate
Aplikasi sulfonates & sulfates :
Sulfonates biasanya digunakan dalam bentuk asam atau garamnya. Industri yang
mengaplikasikan proses sulfonasi cukup luas terutama industri kertas, dengan
produk utama yang dihasilkan adalah lignin sulfonate. Detergent (dodecyl benzene
sulfonate) dihasilkan dengan cara menggabungkan gugus aktif -SO 2OH- sebagai
kutub polar hidrofilik dengan senyawa organik rantai panjang sebagai kutub non
polar hidrofobik.Toluenesulfonic acid digunakan sebagai katalis, phenolsulfonic
acid digunakan sebagai bahan aditif pada proses elektroplating.
Aromatic sulfonil chlorides -RSO2Cl- digunakan sebagai bahan baku pembuatan
sulfoamides seperti obat-obatan sulfa, zat pewarna tekstil, zat penyamak kulit,
plasticizers, pemanis buatan sakarin dan sulfonate ester (insektisida).Herbisida,
pemanis buatan dan antikoagulan darah merupakan jenis Sulfamates.
11.2 Tipe-tipe Proses Sulfonasi
a. Sulfochlorination, , memasukan –SO2Cl pada alkana dengan agent SO2 +Cl
RH + SO2 +Cl RSO2Cl +HCl (11.6)
Sulfonil chloride bahan baku detergent
b.Sulfooksidation , memasukkan SO2 + O2
RH + SO2 + O2 + (CH3CO)2ORSO2OOCOCH3 +CH3COOH (11.7)
RSO2OOCOCH3 + SO2 + 2H2O RSO2OH + CH3COOH (11.8)
Sulfonasi dan Sulfatasi XI - 1
c. Halo sulfonation , reaksi antara halosulfonic acid – ClSO3H atau FSO3H
dengan aromatik atau senyawa hetero siklik untuk memasukan gugus SO2Cl atau
SO2F.
RH + ClSO3H RSO3H + HCl (11.9)
RSO3H + ClSO3H RSO2Cl + H2SO4 (11.10)
d.Sulfoalkylation, memasukan gugus sulfoalkyl ke senyawa hk berberat molekul
besar (polimer, obat-obatan, bahan pencelup) sehingga mudah larut dalam air.
Contoh : sulfomethalation anilin
C6H5NH2 + HOCH2SO3Na C6H5NHCH2SO3Na + H2O (11.11)
anilin formaldehid bisulfite
Formaldehid bisulfite adalah produk sulfonasi yang memiliki 1-3 atom karbon dan
fungsionil yang reaktif (hidroksil, amino, chlorine & aldehid).
11.3 Sulfonating & Sulfating Agents
1. sulfur trioxida
a. SO3, Oleum, concentrated sulfuruc acid paling
banyak di gunakan
b. Chlorosulfonic acid (SO3 + HCl)
2. sulfur dioxida
a. SO2 + Cl2
b. SO2 + O2
c. SO2 + H2O
3. sulfoalkilating agents sulfonates
a. sulfoalkylating agents
- amino ethane sulfonates
H2N – CH2 – CH2SO3H
- hidroksi ethane sulfonates
HO – CH2 – CH2SO3H
b. sulfomethylating agent
- hidroxy dan amino methane sulfonates
11.4 Sulfur Trioksida sebagai Sulfonating dan Sulfating Agents
Ada tiga bentuk dari sulfur trioksida sebagai sulfonating dan sulfating agents
adalah SO3, Oleum dan H2SO4 pekat. Tiga bentuk tersebut memiliki kedekatan
sifat dan paling banyak digunakan di industri. SO3 adalah sulfonating/sulfating
agent yang paling efisien, merupakan polimer dengan struktur :
SO2
O O Trace moisture O O
SO2 O S O S
O
SO2 Bentuk O
γ O
Sulfonasi dan Sulfatasi XI - 2
SO3 memiliki karakteristik padat pada temperatur kamar, memiliki afinitas
terhadap air sangat tinggi dan sulit untuk tetap pada senyawa bentuk SO3, tetapi
selalu berada dalam bentuk hidratnya.SO3 hidrate terurai menjadi SO3 + H2O pada
temperatur 450o C. Reaksi sulfonasi dengan sulfonating agents SO3 adalah:
RH + SO3 RSO3H (11.12)
SO3 hidrate memiliki 2 bentuk yaitu oleum dan H2SO4 pekat, dapat dijelaskan
dengan komposisi berikut:
Monohidrate : SO3. H2O 100% H2SO4
Dihidrate : SO3. 2H2O 84,5% H2SO4
Pyrosulfuric acid : 2SO3. H2O 45% oleum acid
SO3 merupakan spesies reaktif dalam oleum dan asam sulfat pekat. Makin tinggi
kandungan air makin rendah kekuatannya .
Perbandingan proses sulfonasi dengan menggunakan agent H2SO4 dan Oleum
ditunjukkan pada Tabel 13.1.
Tabel 11.1 Perbandingan proses sulfonasi dengan
menggunakan agent H2SO4 dan Oleum (Groggins, 1958)
Faktor H2SO4 Oleum
Laju reaksi Lambat Cepat sekali
Membutuhkan panas untuk
Panas reaksi Sangat eksotermis
menyempurnakan reaksi
Tahap reaksi Sebagian Sempurna
Sisa asam Berarti Tidak ada
Ukuran reaktor Berarti Minimum
Tinggi pada
Viskositas campuran reaksi Rendah
beberapa kasus
Kelarutan dalam pelarut Sangat rendah Larut
organik halogen
Persamaan reaksi sulfonasi senyawa aromatik RH keseluruhan jika menggunakan
agent oleum adalah :
H2SO4
RH + SO3 RSO3H + H2SO4 (11.13)
Kinetika reaksi sulfonasi jika menggunakan agent oleum adalah :
Rate = k2 [ArH][SO3]
Kecepatan reaksi berbanding lurus dengan konsentrasi bahan baku (ArH) dan
konsentrasi SO3.
Sedangkan persamaan reaksi sulfonasi senyawa aromatik jika menggunakan agent
concentrated sulfuric acid (H2SO4 pekat) adalah :
RH + H2SO4 RSO3H + H2O (11.14)
Sulfonasi dan Sulfatasi XI - 3
Kinetika reaksi sulfonasi pada pemakaian agent concentrated sulfuric acid (H2SO4
pekat) adalah :
Rate = k2 [ArH]/[w]2
Karena dihasilkan H2O di akhir proses maka kecepatan reaksi berbanding terbalik
dengan kuadrat konsentrasi air, sehingga kecepatan reaksi akan berkurang secara
berarti.
11.4 Mekanisme Reaksi Sulfonasi
Reaksi sulfonasi merupakan reaksi substitusi elektrofilik. Mekanisme reaksi
sulfonasi untuk benzene dengan oleum sebagai sulfonating agent ditunjukan pada
reaksi di bawah ini.
SO3-
O
-S
H
+ S O
+S H
O
efektrofil
Efektrofil akan menyerang elektron pi
SO3-
SO3- OH OH
H + O S O + H-O+ S O
H+ OH OH
A Menerima proton dari
A
SO3H
+ H2SO4
Jika digunakan H2SO4 pekat mengikuti reaksi:
RH + H2SO4 RSO3H + H2O , akan dihasilkan air
Reaksi sulfonasi merupakan reaksi reversibel atau bolak balik, namun pada
temperatur rendah bersifat irreversibel karena reaksi desulfonasi berjalan sangat
Sulfonasi dan Sulfatasi XI - 4
lambat. Reaksi sulfonasi sangat bergantung pada reaktifitas senyawa aromatis dan
sifat dari senyawa elektrofilik yang diturunkan dari H 2SO4 (asam sulfat) atau SO3
(sulfur trioksida).
Mekanisme reaksi sulfonasi dengan sulfonating agent concentrated H2SO4
diawali dengan pembentukan elektrofilik (SO3). Pada tahap ini terjadi penguraian
asam sulfat.
(11.15)
Pada tahap selanjutnya, terjadi proses penyerangan senyawa naftalen oleh
elektrofilik yang terbentuk .
Reaksi secara keseluruhan :
(11.16)
11.5 Sulfonasi dengan Sulfonating Agent H2SO4
Faktor-faktor yang mempengaruhi proses Sulfonasi :
a.Konsentrasi SO3 pada Sulfonating Agent dalam reaktor
Proses sulfonasi dapat berlangsung dengan baik tergantung pada konsentrasi SO 3
dalam sulfonating agent yang digunakan. Reaksi sulfonasi menggunakan
sulfonating agent H2SO4 akan menghasilkan air sebagai produk sampingnya.
Terbentuknya air selama proses, akan menurunkan konsentrasi asam yang akan
menyebabkan kecepatan reaksi sulfonasi menurun, saat kandungan SO3 habis,
reaksi akan terhenti.
Sulfonasi dan Sulfatasi XI - 5
Konsentrasi SO3 minimum yang diperlukan agar reaksi sulfonasi tetap
berlangsung didefinisikan sebagai π. Persamaan yang menyatakan kebutuhan asam
untuk mensulfonasi 1 mol senyawa organik diuraikan pada persamaan (1).
atau X = 80 . . . . . . . . . . . . . (1)
Dengan X adalah berat asam dalam gram dan α adalah banyaknya SO3 dalam
H2SO4 dalam persen. Setiap senyawa organik memiliki nilai π yang berbeda-beda
seperti yang ditunjukkan Tabel 13.2. Semakin mudah suatu bahan organik
disulfonasi semakin rendah nilai π nya (Groggins, 1958).
Tabel 13.2 Nilai π beberapa senyawa organik
Persen
Nilai π
H2SO4
Naphtalenene (monosulfonation at 60oC) 56 68,5
o
Naphtalenene (monosulfonation at 160 C) 52 63,7
o
Naphtalenene (trisulfonation at 160 C) 79,8 97,3
Nitrobenzenae (monosulfonation) 82 100,1
b.Temperatur Operasi
Proses sulfonasi naftalen membentuk 2 jenis naftalen sulfonat, yaitu α dan
β-naftalen sulfonat. Kedua jenis naftalen sulfonat tersebut berbeda pada
penempatan gugus –SO3H pada naftalennya. Pengaruh temperatur terhadap
pembentukan naftalen sulfonat dan distribusi pembentukan α dan β-naftalen
sulfonat disajikan pada Gambar 2.2 dan Tabel 2.3.
Gambar 12.3 Pembentukan Naftalen Sulfonat pada Temperatur Berbeda
Sulfonasi dan Sulfatasi XI - 6
Pada temperatur rendah, reaksi dikendalikan oleh faktor kinetika atau faktor
cepat-lambatnya reaksi. α-naftalen sulfonat akan lebih cepat terbentuk pada
kondisi ini karena reaksi berlangsung pada jalur energi aktivasi yang lebih rendah.
Reaksi yang berlangsung pada temperatur yang lebih tinggi akan dikendalikan
oleh faktor termodinamika atau faktor kestabilan produk. Pada kondisi ini reaksi
akan menghasilkan β-naftalen sulfonat yang lebih stabil meskipun memiliki energi
aktivasi yang lebih tinggi (Weininger, 1984).
Tabel 11.4 Pengaruh Temperatur terhadap Sulfonasi Naftalen
(Groggins, 1958)
Temp 8 9 1 1 1 1 1 1 1
(oC) 0 0 00 10,5 24 29 38,5 50 61
Alpha 9 9 8 7 5 4 2 1 1
, (%) 1,0 0,0 3,0 2,6 2,4 4,4 8,4 8,3 8,4
Beta 9 1 1 2 4 5 7 8 8
(%) ,0 0,0 7,0 7,4 7,6 5,6 1,6 1,7 1,6
11.6 Faktor-faktor yang Mempengaruhi produk Sulfonasi
a. Temperatur
Kecepatan reaksi sulfonasi naik 2 kali lipat pada kenaikan temperatur 10 oC. Pada
kebanyakan kasus, sulfonasi yang dilakukan pada banyak kasus temperatur rendah
dengan perioda reaksi yang panjang akan menghasilkan produk lebih murni dan
warna lebih terang. Temperatur reaksi berpengaruh pula pada distribusi
membentuk isomer (Groggins,1958).
Tabel 11.5 Pengaruh temperatur terhadap warna produk sulfonasi
dodecylbenze
asam/hk (rasio mol) Temp (oC) Warna
3,26 24 2-3
2,9 29 4-5
2,6 38 5-6
Tabel 11.6 Pengaruh temperatur reaksi pada distribusi pembentukan isomer
sulfonasi toluen
Isomer 25oC(%) 50oC(%)
orto 18-22 12-18
para 4-6 5-6
meta 74-76 78-82
Sulfonasi dan Sulfatasi XI - 7
Temperatur reaksi memberikan efek pembentukan polysulfonates pada sulfonasi
aminobenzene.
Tabel 11.7 Pengaruh temperatur terhadap pembentukan polysulfonates
Temp (oC) Waktu (jam) Produk
0 36 mono
10-12 24 1/2 mono, 1/2 di
19-20 12 di
b. Katalis
Katalis berfungsi untuk mengarahkan posisi NO3 pada produk (orientasi),
contohnya pada sulfonasi anthraquinone, dengan menggunakan katalis Hg
(logam, sulfate, cloride)
O O
SO3H
anthraquinone sulfat
O O
SO3H
Hg
-anthraquinon sulfat
Pengubah orientasi
Contoh pada Sulfonasi naftalen
SO3H
HOSO3H
naftalen sulfonate
pada temperatur rendah
SO3H
naftalen sulfonate
pada temperatur tinggi
Jika pada temperatur yang tinggi diinginkan produk -naftalen sulfonat, maka
digunakan katalis. Katalis berfungsi pula untuk menekan reaksi samping.Contoh
Sulfonasi dan Sulfatasi XI - 8
produk samping sulfone dapat ditekan dengan pemberian katalis asam asetat
anhidrid atau natrium sulfat sebanyak 5% dari berat hidrokarbon (bahan baku),
RSO3SO3H + RH R2SO2 + H2SO4 (11.17)
c. Pelarut sulfonate/media suspensi
Beberapa kasus sulfonasi selama proses berlangsung dihasilkan produk yang
viskositasnya tinggi, bahkan memadat sehingga dibutuhkan media untuk
melarutkan produk tersebut agar pengadukan tetap berlangsung.Pelarut yang
digunakan adalah pelarut klor, yaitu:
methylene chloride
chloroform
CCl4
Orto dichlorobenzene
Yang memiliki karakteristik sebagai berikut, tidak larut dalam air, relativ inert,
stabil, titik didih tinggi
Pelarut lain yang dapat digunakan adalah SO2 cair yang memiliki sifat murah,
inert, non flammable, larut dalam sulfonating agent, produk sulfonates, refrigerant
(bp:-10oC), bau tajam, korosif, operasi pada tekanan rendah. SO2 cair digunakan
untuk sulfonasi toluene, dodecyl benzene, detergent alkylate, sulfating alkohol
berantai panjang.
11.7 Pemisahan Produk sulfonasi dari Kelebihan Pereaksi H2SO4
a. Pengeceran dengan air
Produk sulfonic acid relatif tidak larut dalam H2SO4 dengan konsentrasi (50-80%)
terbentuk layer (lapisan) yang mudah dipisahkan.
b. Penambahan larutan NaCl, Na2SO4
RSO3H + NaCl RSO3Na + HCl
RSO3Na akan mengendap (proses salting out)
c.Penambahan Ca(OH)2 atau CaCO3
SO3
SO3H
+ Ca(OH)2 Ca + 2H2O
(
2
calsium sulfonate Larut
Sulfonasi dan Sulfatasi XI - 9
H2SO4 + Ca(OH)2 CaSO4 + 2H2O (11.18)
Mengendap
H2SO4 + CaCO3 CaSO4 + 2H2O + CO2 (11.19)
Mengendap
11.8 Aplikasi Proses Sulfonasi
a. Sulfonasi benzene
Benzene water 6
vapor
30%
2 H2SO4
+ hasil 5
reaksi
1
Jacket
produk
Uap benzene
4
3 3
Gambar 11.4 Flow sheet sulfonasi benzene
1. tanki asam sulfat
2. reaktor (cast iron dilapisi glass, enamol)
3. tanki benzene
4. vaporizer superheater
5. sulfonation tower (7 stage) plate column
6. kondenser
Sulfonasi benzene scara kontinyu menggunakan metoda destilasi tekanan parsial.
Benzene dialirkan dari tangki benzene ke dalam reaktor dengan menggunakan
Sulfonasi dan Sulfatasi XI - 10
pompa. Di dalam reaktor, asam sulfat bereaksi dengan benzene aliran keluar
reaktor terdiri dari 30% H2SO4 yang tak bereaksi dan produk hasil reaksi menuju
bagian atas sulfonation tower. Dari dasar sulfonation tower dialirkan uap
benzene , sehingga campuran uap air-uap benzene akan terbentuk dan keluar dari
bagian atas sulfonation tower menuju kondensor. Di dalam kondensor benzene
akan terkondensasi dan dikembalikan ke tangki benzene. Pada kondisi optimum,
temperatur reaksi 180oC untuk 10 mol benzen per mol H 2SO4 dibutuhkan waktu
reaksi selama 1,5 jam. Produk yang dihasilkan memiliki komposisi sebagai
berikut; benzene sulfonic acid, 3-4% H2SO4, dan 2,5-3,5% sulfone
b. Sulfonasi dodecylbenzene
Sulfonasi dodecylbenzene dengan 20% oleum mengikuti persamaan reaksi
berikut:
H2SO4
C12H25C6H5 + SO3 C12H25C6H4SO3H + H2SO4 (11.20)
Untuk 11.000 lb/ 1500 gal bahan baku hidrokarbon digunakan reaktor yang
dilapisi glass yang berkapasitas 1.500 galon, dilengkapi dengan pengaduk
berkekuatan 10 hp dan pipa pendingin berkapasitas 1000 ft2. 13.750 lb oleum 20%
dialirkan sesegera mungkin ke dalam reaktor, temperatur dijaga tidak melebihi
30oC. Reaksi berlangsung selama 1,5 – 2 jam, diikuti dengan pematangan selama
2 jam pada 30oC untuk menyempurnakan reaksi. Di akhir reaksi akan terbentuk
sulfonic acid dan sisa asam 98,2%. Pemisahan dilakukan dengan penambahan air
2660 lb dan diaduk dengan kekuatan penuh, kemudian didinginkan pada
temperatur 60oC sehingga terbentuk lapisan sulfonic acid dan sisa asam 78%.
Pemisahan lapisan dilakukan setelah 4 jam pengendapan , lapisan asam sisa (di
bagiab bawah) dipisahkan , sedangkan sulfonic acid (bagian atas) dinetralisir
dengan penambahan kaustik soda 3006 lb 20% pada suhu 55 oC dan pH 7,5 – 8 .
Yield sulfonic acid bisa mencapai 99%.
Sulfonasi dan Sulfatasi XI - 11
Gambar 11.5 Diagram Alir Sulfonasi dodecylbenzene (Groggins, 1958)
c.Sulfonasi anilin
Persamaan reaksinya mengikuti:
H2NC6H5 + H2SO4 H2NC6H4SO3H + H2O (11.21)
Sulfonasi anilin dilakukan dengan metode “backing”. Asam sulfat 3520 lb 92%
dialirkan ke dalam sebuah reaktor cast-iron yang dilengkapi dengan pengaduk
propeler. Anilin 3030 lb, 32,5 lbmol dialirkan melalui orifice sehingga temperatur
reaktor naik sampai 150oC. Uap air dan anilin direfluk dengan menggunakan
kondensor. Dua jam setelah penambahan anilin reaksi sudah sempurna.
Sulfonic acid dihasilkan dalam bentuk pasta, ditempatkan dalam rak-rak susun.
Untuk komposisi bahan baku di atas dibutuhkan 132 rak. Rak-rak dimasukan ke
dalam “backing oven” selama 75 menit. Pembakaran ini berlangsung selama 12,5
jam. Pembakaran dilakukan dengan menggunakan udara kering bertemperatur
260-280oC. Rak-rak tersebut kemudian dimasukan dalam ruang pendingin selama
1,25 jam. Produk yang dihasilkan berkadar 97% dengan yield 5620 lb atau 98%
dari reaksi stoikiometri.
Sulfonasi dan Sulfatasi XI - 12
DAFTAR PUSTAKA
1. Fessenden, R. and Fessenden, J., 1982.,”Organic Chemistry”, 2nd Edition,
Willard Grant Press Publisher, Massachusetts, USA.
2. Groggins, P. H., “Unit Processes in Organic Synthesis”, fifth Edition,
International Student Edition, Mc. Graw – Hill Kogakusha, Ltd. 1958.
3. Hart Harold, Terj. Achmadi Suminar, “Kimia Organik, Suatu Kuliah
Singkat”, Penerbit Erlangga, Jakarta, 1987.
.
Sulfonasi dan Sulfatasi XI - 13
Anda mungkin juga menyukai
- Makalah Asil HalidaDokumen11 halamanMakalah Asil HalidaNiluh putu Satria maharaniBelum ada peringkat
- Makalah Fix SulfonasiDokumen20 halamanMakalah Fix SulfonasiBayu Rajindra100% (1)
- Makalah KimorDokumen14 halamanMakalah KimorKhalifah NahumaruryBelum ada peringkat
- Reaksi-Reaksi Dalam Senyawa AminaDokumen14 halamanReaksi-Reaksi Dalam Senyawa Aminaferdina wahyuBelum ada peringkat
- Percobaan VDokumen26 halamanPercobaan VNovitaBelum ada peringkat
- Spektrofotometri Uv-VisDokumen47 halamanSpektrofotometri Uv-VisIhans23Belum ada peringkat
- SulfonasiDokumen5 halamanSulfonasihanna noviyantiBelum ada peringkat
- Derivat Asam KarboksilatDokumen6 halamanDerivat Asam KarboksilatYolanda Muliana PanjaitanBelum ada peringkat
- Asam PikratDokumen5 halamanAsam Pikratmaudina alfira adzaniBelum ada peringkat
- Aldehid Dan KetonmixDokumen100 halamanAldehid Dan Ketonmixdayang daulayBelum ada peringkat
- Percobaan Asam KarboksilatDokumen7 halamanPercobaan Asam KarboksilatShofiana ShofyeBelum ada peringkat
- Inversi Gula (Punya Sendiri)Dokumen35 halamanInversi Gula (Punya Sendiri)Firman AjiBelum ada peringkat
- Percobaan Viii Senyawa Karboksilat Dan EsterpdfDokumen13 halamanPercobaan Viii Senyawa Karboksilat Dan EsterpdfDevi IndrianiBelum ada peringkat
- Makalah Responsi Kimia Organik ResponsiDokumen18 halamanMakalah Responsi Kimia Organik ResponsiveradelaBelum ada peringkat
- Kimia Organik Senyawa AromatikDokumen26 halamanKimia Organik Senyawa AromatikRetno Dwi HartantiBelum ada peringkat
- Laporan Nitrobenzene TasyaDokumen21 halamanLaporan Nitrobenzene Tasyanina adatiBelum ada peringkat
- Sulfonasi Senyawa AromatikDokumen12 halamanSulfonasi Senyawa AromatikYogaPratamaBelum ada peringkat
- Asam Karboksilat, Amina Dan AlkoholDokumen5 halamanAsam Karboksilat, Amina Dan AlkoholPutri1202Belum ada peringkat
- Modul Kimia Organik (Asam Amino)Dokumen23 halamanModul Kimia Organik (Asam Amino)Fitra Bulex100% (1)
- ElektrofilikDokumen19 halamanElektrofiliknora santiBelum ada peringkat
- Laporan Resmi Sintesis DibenzilasetonDokumen20 halamanLaporan Resmi Sintesis DibenzilasetonAzka AmandaBelum ada peringkat
- Tian Amalda Sabrina. Sifat Fisik Dan Kimia SenyawaDokumen16 halamanTian Amalda Sabrina. Sifat Fisik Dan Kimia SenyawaTian Amalda SabrinaBelum ada peringkat
- Kimia Analisa Kation Dan AnionDokumen74 halamanKimia Analisa Kation Dan AnionFelia UtamiBelum ada peringkat
- Sifat Fisika Dan Kimia Molekul Obat Dan GravimetriDokumen29 halamanSifat Fisika Dan Kimia Molekul Obat Dan GravimetriErin FebrianBelum ada peringkat
- Sifat MetanaDokumen1 halamanSifat MetanaEgit Andika PBelum ada peringkat
- Aromatik IIDokumen30 halamanAromatik IILizma FebrinaBelum ada peringkat
- Alkil Halida-1Dokumen8 halamanAlkil Halida-1ListiaBelum ada peringkat
- Asam Basa PH Buffer HidrolisaDokumen16 halamanAsam Basa PH Buffer HidrolisaWarsitoIbrahimBelum ada peringkat
- Kimia Analitik KualitatifDokumen7 halamanKimia Analitik KualitatifEkha WidianthyBelum ada peringkat
- NitrimetrikDokumen25 halamanNitrimetrikStifar S1B 14Belum ada peringkat
- Reaksi Senyawa Organik Dan Mekanisme1Dokumen12 halamanReaksi Senyawa Organik Dan Mekanisme1Balqis MnisaBelum ada peringkat
- HeterosiklikDokumen21 halamanHeterosiklikفرحان الانصريBelum ada peringkat
- ALKALOIDDokumen44 halamanALKALOIDreffina sukma dewiBelum ada peringkat
- Argentometri IHTDokumen64 halamanArgentometri IHTNur Kamilah IdzanBelum ada peringkat
- METANADokumen12 halamanMETANALauren DunnBelum ada peringkat
- Bentuk Senyawa SiklikDokumen6 halamanBentuk Senyawa SiklikLatifa El Chasany100% (1)
- Prinsip Dasar Sintesis Senyawa AromatisDokumen26 halamanPrinsip Dasar Sintesis Senyawa AromatisValentino KrismonicoBelum ada peringkat
- EpoksidaDokumen4 halamanEpoksidaMaila KhaririBelum ada peringkat
- Makalah Reaksi Alkohol Dan FenolDokumen10 halamanMakalah Reaksi Alkohol Dan FenolSatria Zebua ChannelBelum ada peringkat
- Pertemuan 5 - Analisis GravimetriDokumen24 halamanPertemuan 5 - Analisis GravimetriPutti AnnisaBelum ada peringkat
- Perbedaan Larutan, Koloid, Dan SuspensiDokumen2 halamanPerbedaan Larutan, Koloid, Dan SuspensiRahmayanti PramadiBelum ada peringkat
- Kunci WorksheetDokumen9 halamanKunci WorksheetRyan CrysandiBelum ada peringkat
- Lap Biokim Objk3Dokumen28 halamanLap Biokim Objk3Fadhil FerdianBelum ada peringkat
- Laporan Praktikum Kimia OrganikDokumen26 halamanLaporan Praktikum Kimia OrganikFitri WahyuniBelum ada peringkat
- Halogen As IDokumen52 halamanHalogen As IRizkaKhairiyyahBelum ada peringkat
- Sil OrlaDokumen4 halamanSil OrlaErwinKurniawanBelum ada peringkat
- Tugas Kimia OrganikDokumen5 halamanTugas Kimia OrganikBella Nur AfindaBelum ada peringkat
- Reaksi CannizzaroDokumen3 halamanReaksi Cannizzarobaiq chairun nisaBelum ada peringkat
- Amina, Amida, Nitril, PolimerDokumen13 halamanAmina, Amida, Nitril, PolimerRega LinzaBelum ada peringkat
- Sintesis KimiaDokumen24 halamanSintesis Kimia26090Siti Nour AzizahBelum ada peringkat
- Laporan Praktikum Alkohol Dan Fenol Universitas HasanuddinDokumen17 halamanLaporan Praktikum Alkohol Dan Fenol Universitas HasanuddinAndiGunawan50% (2)
- Sejarah BenzenaDokumen4 halamanSejarah Benzenaanggun2901Belum ada peringkat
- TugasDokumen38 halamanTugasFitri HardiyantiBelum ada peringkat
- Modul Viii Sulfonasi NaftalenDokumen12 halamanModul Viii Sulfonasi Naftaleniqbal m farizBelum ada peringkat
- Laporan SulfonasiDokumen10 halamanLaporan Sulfonasinoormanurmalasari07Belum ada peringkat
- 4 - Sulfonasi Dan SulfatasiDokumen24 halaman4 - Sulfonasi Dan SulfatasiEmitalutfiahBelum ada peringkat
- Laporan Naftalen SulfonatDokumen30 halamanLaporan Naftalen Sulfonatseptianhrdp100% (1)
- Laporan SulfonasiDokumen17 halamanLaporan SulfonasiTianAnugerahMulyanaBelum ada peringkat
- SulfonasiDokumen28 halamanSulfonasiTITIBelum ada peringkat
- SulfonasiDokumen12 halamanSulfonasiMaria NovansyaBelum ada peringkat
- Laprak Lengkap TRDokumen23 halamanLaprak Lengkap TRAisyah HaurainaBelum ada peringkat
- Scamper Method - KwuDokumen12 halamanScamper Method - KwuAisyah HaurainaBelum ada peringkat
- Bab 2 Sumber PatiDokumen4 halamanBab 2 Sumber PatiAisyah HaurainaBelum ada peringkat
- Stirred Tank Reaktor Kelompok 1tkpbDokumen12 halamanStirred Tank Reaktor Kelompok 1tkpbAisyah HaurainaBelum ada peringkat
- Laprak Las Listrik Kelompok 1 TKPBDokumen25 halamanLaprak Las Listrik Kelompok 1 TKPBAisyah HaurainaBelum ada peringkat
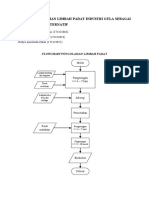
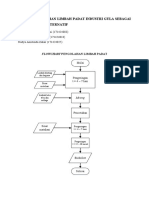
- Tugas Pengolahan Limbah Padat Industri Gula Sebagai Bahan Bakar AlternatifDokumen2 halamanTugas Pengolahan Limbah Padat Industri Gula Sebagai Bahan Bakar AlternatifAisyah HaurainaBelum ada peringkat
- Buku Ajar Mi TK PolbanDokumen98 halamanBuku Ajar Mi TK PolbanAisyah HaurainaBelum ada peringkat
- TugasDokumen11 halamanTugasAisyah HaurainaBelum ada peringkat
- Laprak Lengkap TRDokumen23 halamanLaprak Lengkap TRAisyah HaurainaBelum ada peringkat
- Business Model Canvas CimoryDokumen2 halamanBusiness Model Canvas CimoryAisyah HaurainaBelum ada peringkat
- Tugas Pengolahan Limbah Padat Industri Gula Sebagai Bahan Bakar AlternatifDokumen2 halamanTugas Pengolahan Limbah Padat Industri Gula Sebagai Bahan Bakar AlternatifAisyah HaurainaBelum ada peringkat
- Form BimbinganDokumen5 halamanForm BimbinganAisyah HaurainaBelum ada peringkat
- FORMULASI Facial FoamDokumen24 halamanFORMULASI Facial FoamBayyinah Ardian100% (3)
- Uts PLPG 2019Dokumen5 halamanUts PLPG 2019Aisyah HaurainaBelum ada peringkat
- Tugas 3Dokumen17 halamanTugas 3Aisyah HaurainaBelum ada peringkat
- TUGAS SCAMPER Aisyah Hauraina A 171424003 (3A TKPB)Dokumen6 halamanTUGAS SCAMPER Aisyah Hauraina A 171424003 (3A TKPB)Aisyah HaurainaBelum ada peringkat
- 1384 - Laporan Wirus Selling ProjectDokumen18 halaman1384 - Laporan Wirus Selling ProjectAisyah HaurainaBelum ada peringkat
- Pengeringan 3 2018Dokumen26 halamanPengeringan 3 2018Aisyah HaurainaBelum ada peringkat
- Zero WasteDokumen4 halamanZero WasteAisyah HaurainaBelum ada peringkat
- Tugas Pengolahan Limbah Padat Industri Gula Sebagai Bahan Bakar AlternatifDokumen2 halamanTugas Pengolahan Limbah Padat Industri Gula Sebagai Bahan Bakar AlternatifAisyah HaurainaBelum ada peringkat
- Jawaban UTS PLPGDokumen8 halamanJawaban UTS PLPGAisyah HaurainaBelum ada peringkat
- Bab I Dasar Pertukaran KalorDokumen12 halamanBab I Dasar Pertukaran KalorAisyah HaurainaBelum ada peringkat
- Alat-Alat EkstraksiDokumen3 halamanAlat-Alat EkstraksiAisyah HaurainaBelum ada peringkat
- Bab 1Dokumen36 halamanBab 1Aisyah HaurainaBelum ada peringkat
- Alat-Alat EkstraksiDokumen3 halamanAlat-Alat EkstraksiAisyah HaurainaBelum ada peringkat
- Selling Project - Kelompok 6Dokumen44 halamanSelling Project - Kelompok 6Aisyah HaurainaBelum ada peringkat
- TugasDokumen2 halamanTugasAisyah HaurainaBelum ada peringkat
- Handbook Week 81Dokumen16 halamanHandbook Week 81Aisyah HaurainaBelum ada peringkat