0% menganggap dokumen ini bermanfaat (0 suara)
130 tayangan10 halamanSumber dan Penggunaan Gas Mulia
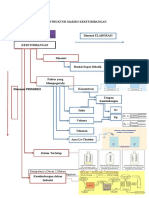
Teks ini membahas tentang gas mulia, termasuk sumber, kelimpahan, sifat fisik, dan senyawa kimia gas mulia seperti helium, neon, argon, kripton, xenon, dan radon. Gas mulia ditemukan terutama dalam udara dan batuan beku, dan dapat membentuk berbagai senyawa fluorida dan oksida melalui reaksi kimia. Kontroversi penamaan "gas mulia" juga dibahas karena gas mulia tidak selalu tidak reaktif.
Diunggah oleh
Ella Nur AnisaHak Cipta
© © All Rights Reserved
Kami menangani hak cipta konten dengan serius. Jika Anda merasa konten ini milik Anda, ajukan klaim di sini.
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online di Scribd
0% menganggap dokumen ini bermanfaat (0 suara)
130 tayangan10 halamanSumber dan Penggunaan Gas Mulia
Teks ini membahas tentang gas mulia, termasuk sumber, kelimpahan, sifat fisik, dan senyawa kimia gas mulia seperti helium, neon, argon, kripton, xenon, dan radon. Gas mulia ditemukan terutama dalam udara dan batuan beku, dan dapat membentuk berbagai senyawa fluorida dan oksida melalui reaksi kimia. Kontroversi penamaan "gas mulia" juga dibahas karena gas mulia tidak selalu tidak reaktif.
Diunggah oleh
Ella Nur AnisaHak Cipta
© © All Rights Reserved
Kami menangani hak cipta konten dengan serius. Jika Anda merasa konten ini milik Anda, ajukan klaim di sini.
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online di Scribd