Worksheet Perc 6 - Khoerul Ummah
Diunggah oleh
Khoer UmmahJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Worksheet Perc 6 - Khoerul Ummah
Diunggah oleh
Khoer UmmahHak Cipta:
Format Tersedia
KEMENTERIAN AGAMA REPUBLIK INDONESIA
UNIVERSITAS ISLAM NEGERI WALISONGO SEMARANG
FAKULTAS SAINS DAN TEKNOLOGI
Jalan Prof. Dr. Hamka Kampus II Ngaliyan Telepon (024) 76433366 Semarang 50185
WORKSHEET PRAKTIKUM KIMIA LOGAM DAN NON LOGAM
PEMBUATAN SENYAWA KOORDINASI Ni(NH3)6I2
Petunjuk Pengerjaan:
1. Melihat video sebagai berikut:
a. https://www.youtube.com/watch?v=x_QR_tJgDCU
b. https://www.youtube.com/watch?v=_2C0BMlkNLk
2. Menganalisis video praktikum tersebut.
Hasil Analisis Video Praktikum:
Tujuan praktikum pada masing-masing video:
Video 1 = Mempelajari pembuatan senyawa koordinasi [Ni{NH3}6]I2
Video 2 = Melakukan uji keberadaan ion nikel pada larutan
Bahan apa saja yang digunakan pada kegiatan praktikum video (a)? Adakah perbedaan
dengan yang tertulis di buku panduan praktikum? Jika ada sebutkan.
Bahan:
1. Padatan NH4Cl
2. Aquades
3. Padatan NiCl2.6H2O
4. Larutan ammonia
5. Etanol
6. Es batu
Perbedaan:
1. Pembuatan senyawa koordinasi dalam video berupa NiCl 2.6H2O sedangkan di buku
panduan NiSO4.6H2O
2. Di video menggunakan NH4Cl untuk ditambahkan pada logam Ni2+ sedangkan di panduan
menggunakan KI
worksheet praktikum kimia logam dan non logam
KEMENTERIAN AGAMA REPUBLIK INDONESIA
UNIVERSITAS ISLAM NEGERI WALISONGO SEMARANG
FAKULTAS SAINS DAN TEKNOLOGI
Jalan Prof. Dr. Hamka Kampus II Ngaliyan Telepon (024) 76433366 Semarang 50185
Tuliskan langkah kerja pada video (a) dan (b), kemudian tentukan tujuan/ maksud pada
setiap langkah kerja dan hasil pengamatan anda!
Langkah Fungsi/ Tujuan setiap
No Hasil pengamatan
percobaan langkah kerja
Agar dapat terlarut Kristal NH4Cl (serbuk
4 gr NH4Cl + 10 putih) + H2O (bening)
1.
mL air menjadi cairan putih
keruh
Agar dapat terlarut Nikel klorida (hijau) +
air (tak berwarna)
5 gr nikel klorida +
2. ( nikel larut dalam air
4 mL air
dan larutan berwarna
hijau.
Supaya terbentuk senyawa Larutan sebelumnya
koordinasi (hijau) + larutan NH4Cl
3. Ditambah NH4Cl
(bening) larutan tetap
berwarna hijau
Sebagai katalis dalam Campuran (hijau) +
Ditambah + 10 mL keadaan basa NH3 (tak berwarna)
4. NH3 pekat larutan berubah menjadi
berwarna biru.
Agar terbentuk sebuah Terbentuk 2 fasa, cair
kristal/padatan dan endapan dan
Di dinginkan selama Terdapat endapan
5.
1 jam pada ice bath berupa kristal berwarna
ungu dan larutan
bening.
Agar terpisah dari Kristal yang masih
Larutan di saring
filtratnya, sehingga hanya tertinggal pada corong
6. dan di tambahkan
diperoleh kristalnya ikut larut ke dalam
amonia pekat
penyaringan
worksheet praktikum kimia logam dan non logam
KEMENTERIAN AGAMA REPUBLIK INDONESIA
UNIVERSITAS ISLAM NEGERI WALISONGO SEMARANG
FAKULTAS SAINS DAN TEKNOLOGI
Jalan Prof. Dr. Hamka Kampus II Ngaliyan Telepon (024) 76433366 Semarang 50185
Langkah Fungsi/ Tujuan setiap
No Hasil pengamatan
percobaan langkah kerja
Disiram dengan Agar bersih dari zat Semua kristal beserta
pengotor etanol masuk kedalam
7. etanol
gelas ukur di bawah
penyaring
Mengurangi kadar air
Kristal di keringkan
pada kristal agar Kristal mengering dan
8. di dalam oven terbentuk kristal yang tetap berwarna ungu
dengan suhu 50°C sempurna
Video ke 2
Untuk melakukan uji NiCl (bening) + H2SO4
1. Larutan NiCl + keberadaan ion nikel (bening) hasil
H2SO4 pada larutan larutannya juga bening
Untuk melakukan uji NiCl (bening) + (DMG
Larutan NiCl + keberadaan ion nikel +Etanol ) berwarna
2.
pada larutan putih keruh hasil larutan
(DMG +Etanol)
bening
Untuk melakukan uji NiCl (bening) +
Larutan NiCl + keberadaan ion nikel NH4OH (bening) hasil
3.
pada larutan larutannya berwarna
NH4OH
merah muda
Tuliskan langkah kerja di buku panduan (perc VI), kemudian tentukan tujuan/ maksud
pada setiap langkah kerja!
No Langkah percobaan Fungsi/ Tujuan setiap langkah kerja
Larutkan 1 gram Agar nikel menjadi larut
1. NiSO4.6H2O ke dalam 5
ml air dalam gelas beaker
2. Tempatkan gelas beaker Ditaruh dilemari asap agar menghindari
dalam lemari asap dan inhalasi penghirupan larutan yang bisa
tambahkan 10 ml ammonia
worksheet praktikum kimia logam dan non logam
KEMENTERIAN AGAMA REPUBLIK INDONESIA
UNIVERSITAS ISLAM NEGERI WALISONGO SEMARANG
FAKULTAS SAINS DAN TEKNOLOGI
Jalan Prof. Dr. Hamka Kampus II Ngaliyan Telepon (024) 76433366 Semarang 50185
No Langkah percobaan Fungsi/ Tujuan setiap langkah kerja
pekat berdampak berbahaya,
Tambahkan 2,6 gram KI pereaksi
ke dalam campuran. Dan
3.
biarkan campuran selama
15 menit
Kumpulkan kristal yang untuk membebaskan senyawa tersebut dari
terbentuk dengan unsur-unsur lain.
penyaring Hirsch, cuci dua
4. kali dengan 2 ml larutan Etanol memiliki titik didih rendah sehingga
etanol 1:1 dan tambahkan udah menguap dan mengakibatkan mudah
2 ml larutan etanol ke tebentuknya kristal.
dalam larutan
Keringkan kristal pada Untuk mengeringkan kristal yang masih
5. udara terbuka selama ada sisa etanol
beberapa menit
Hitung rendemen kristal Untuk mengetahui seberapa persen
6. yang terbentuk endapan yang dihasilkan dengan
dibandingkan endapan teoretisnya
Untuk menguji keberadaan amoniak berguna sebagai katalis dan
ion Ni2+ di dalam menunjukkan bahwa reaksi dalam keadaan
campuran, larutkan basa sehingga dapat membentuk endapan
sejumlah kecil sampel nikel, dan juga dimetil glikosim akan lebih
(0,001 gram kedalam 0,5 cepat terbentuk dalam suasana basa.
7.
ml air) dan tambahkan
larutan ammonia 5 M dan
tambahkan 5 tetes larutan Fungsi dimetil glikosim adalah sebagai
DMG. Amati indicator yang menunjukkan jika ada unsur
perubahannya. tertentu dengan timbulnya warna tertentu.
8. Untuk menguji keberadaan asam sulfat berguna sebagai katalis
ion iodida, dapat dilakukan sehingga dapat menunjukkan bahwa reaksi
dengan melarutkan dlam keadaan asam, dan juga untuk
sejumlah kecil campuran pelepasan iod (I2) pada saat penambahan
(0,001 gram kedalam 0,5 H2O2. Indicator yang digunakan adalah
ml air), kemudian asamkan amilum. Ketika ditambah amilum warna
dengan 2 tetes H2SO4 5 M larutan berubah menjadi biru. Hal ini
worksheet praktikum kimia logam dan non logam
KEMENTERIAN AGAMA REPUBLIK INDONESIA
UNIVERSITAS ISLAM NEGERI WALISONGO SEMARANG
FAKULTAS SAINS DAN TEKNOLOGI
Jalan Prof. Dr. Hamka Kampus II Ngaliyan Telepon (024) 76433366 Semarang 50185
No Langkah percobaan Fungsi/ Tujuan setiap langkah kerja
dan kemudian tambahkan menandakan bahwa didalam larutan
larutan H2O2 3%. terkandung ion iodida.
Tambahkan indikator
amilum beberapa tetes
Tuliskan reaksi yang terjadi pada setiap video dan reaksi yang terjadi pada senyawa yang
tertulis di buku panduan praktikum untuk percobaan VI!
1. Buku Panduan
Ni(s) + 6 H2O(l) → [Ni(H2O)6]2+
Ni2+ + 2 NH3 + 2 H2O → [Ni(H2O)6]2+ + 2 OH-
Ni(OH)2 + 6 NH3 → [Ni(NH3)6]2+ + 2 OH-
[Ni(NH3)6]2+ + 2 OH- + 2 KI → [Ni(NH3)6]I2 + KOH
2. Video a
Ni(s) + 6 H2O(l) → [Ni(H2O)6]2+
Ni2+ + 2 NH3 + 2 H2O → [Ni(H2O)6]2+ + 2 OH-
Ni(OH)2 + 6 NH3 → [Ni(NH3)6]2+ + 2 OH-
[Ni(NH3)6]2+ + 2 OH- + NH4Cl → [Ni(NH3)6]Cl2 + NH4(OH)2
3. Video b
Ni2+(aq) + 2 H2DMG(aq) + 2 OH- → Ni(HDMG)2 (s) + 2 H2O (l)
worksheet praktikum kimia logam dan non logam
KEMENTERIAN AGAMA REPUBLIK INDONESIA
UNIVERSITAS ISLAM NEGERI WALISONGO SEMARANG
FAKULTAS SAINS DAN TEKNOLOGI
Jalan Prof. Dr. Hamka Kampus II Ngaliyan Telepon (024) 76433366 Semarang 50185
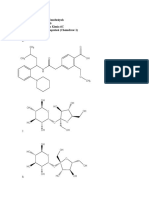
Gambarkan struktur geometri molekul senyawa koordinasi pada video (a), (b), dan
senyawa koordinasi sesuai percobaan VI (buku panduan praktikum)!
worksheet praktikum kimia logam dan non logam
KEMENTERIAN AGAMA REPUBLIK INDONESIA
UNIVERSITAS ISLAM NEGERI WALISONGO SEMARANG
FAKULTAS SAINS DAN TEKNOLOGI
Jalan Prof. Dr. Hamka Kampus II Ngaliyan Telepon (024) 76433366 Semarang 50185
Mengapa NiCl2 maupun NiSO4 dapat bereaksi dengan ammonia dan menghasilkan
senyawa kompleks heksaammin nikel(II)?
worksheet praktikum kimia logam dan non logam
KEMENTERIAN AGAMA REPUBLIK INDONESIA
UNIVERSITAS ISLAM NEGERI WALISONGO SEMARANG
FAKULTAS SAINS DAN TEKNOLOGI
Jalan Prof. Dr. Hamka Kampus II Ngaliyan Telepon (024) 76433366 Semarang 50185
Karena Ni(II) adalah salah satu unsur transisi dimana Ni(II) sebagai atom pusat. Dapat
bereaksi dengan ammonia dikarenakan ammonia merupakan ligan yang memiliki energi yang
cukup besar sehingga dapat bereaksi dengan atom pusat dan kemudian terbentuklah senyawa
koordinasi/kompleks heksaammin nikel(II)
Berdasarkan reaksi pada video (b), gambarkan struktur dimetilglioksim (DMG) dan
jelaskan mengapa DMG dapat digunakan untuk menguji keberadaan ion nikel!
Karena fungsi dimetil glikosim adalah sebagai indicator yang menunjukkan jika ada unsur
tertentu dengan timbulnya warna tertentu. Setelah ditambahkan larutan dimetil glikosim,
larutan berubah warna menjadi merah muda yang menandakan bahwa didalam larutan
tersebut mengandung ion nikel.
Jika 0,5 gram nikel sulfat direaksikan dengan 1,3 gram kalium iodida dapat menghasilkan
1,2 gram senyawa heksaammin nikel(II) iodida, hitung berapakah %rendemen senyawa
koordinasi yang terbentuk
TERDAPAT PADA LAMPIRAN
Tuliskan kesimpulan yang anda peroleh dari pengamatan yang telah dilakukan!
1. Pembuatan senyawa koordinasi [Ni(NH3)6]I2 adalah dengan proses kristalisasi.
2. Etanol berfungsi untuk mengikat sisa air dan larutan lain yang masih terkandung
dalam kristal.
3. Endapan berwarna merah strawberry pada uji ion nikel menunjukkan adanya ion
nikel dalam larutan.
4. Amonia pada uji nikel berfungsi sebagai pemberi suasana basa.
5. Besar randemen adalah 89,61%
worksheet praktikum kimia logam dan non logam
KEMENTERIAN AGAMA REPUBLIK INDONESIA
UNIVERSITAS ISLAM NEGERI WALISONGO SEMARANG
FAKULTAS SAINS DAN TEKNOLOGI
Jalan Prof. Dr. Hamka Kampus II Ngaliyan Telepon (024) 76433366 Semarang 50185
Semarang, 7 Mei 2020
Dosen Pengampu Praktikan
( Bu Resi Pratiwi M.Pd.) (Khoerul Ummah)
worksheet praktikum kimia logam dan non logam
Anda mungkin juga menyukai
- Kelompok 4 Koefisien Distribusi Dan Ketetapan Kesetimbangan - 260110190082 - Clara Fernanda Kusuma PDFDokumen21 halamanKelompok 4 Koefisien Distribusi Dan Ketetapan Kesetimbangan - 260110190082 - Clara Fernanda Kusuma PDFClara Fernanda KusumaBelum ada peringkat
- Ailsa Rahma Yunita - M0318007 - Percobaan 2 - AnorganikDokumen31 halamanAilsa Rahma Yunita - M0318007 - Percobaan 2 - AnorganikIntan ZuhaelaBelum ada peringkat
- Siklus Krebs LanjutDokumen21 halamanSiklus Krebs LanjutNurhidayat DayatBelum ada peringkat
- KD 2 - 55Dokumen6 halamanKD 2 - 55Ovios WBelum ada peringkat
- Laporan Lipida (Irwan) IIDokumen27 halamanLaporan Lipida (Irwan) IIBalqis Nilnaizar RamadhanBelum ada peringkat
- Hidrokarbon Aromatik Poliinti, Kel 6Dokumen32 halamanHidrokarbon Aromatik Poliinti, Kel 6Rahmadina BrodieBelum ada peringkat
- Bab IV - Amina Dan AmidaDokumen17 halamanBab IV - Amina Dan AmidaNasroedien FikryBelum ada peringkat
- Percobaan 3Dokumen7 halamanPercobaan 3Tobing SandroBelum ada peringkat
- Laporan Praktikum Kad 5 Clarisa 1908036044Dokumen25 halamanLaporan Praktikum Kad 5 Clarisa 1908036044Clarisa ArviantiBelum ada peringkat
- Kimia BelerangDokumen9 halamanKimia Belerangmario sebastiano50% (2)
- Laporan Praktikum Kimia Organik Reaksi AdisiDokumen5 halamanLaporan Praktikum Kimia Organik Reaksi AdisiEvolando HiskiaBelum ada peringkat
- Daftar Pustaka AnorDokumen3 halamanDaftar Pustaka AnorBahrilBelum ada peringkat
- Kelompok 7A - Alifa Siti Assyam Nurfatihah - 2282200063 - Praktikum 8 SINTESIS Senyawa KompleksDokumen15 halamanKelompok 7A - Alifa Siti Assyam Nurfatihah - 2282200063 - Praktikum 8 SINTESIS Senyawa KompleksALIFA SITI ASSYAM NURFATIHAHBelum ada peringkat
- Gusti Nugraha - Laporan Praaktikum Pembuatan Kalium NitratDokumen12 halamanGusti Nugraha - Laporan Praaktikum Pembuatan Kalium NitratGusti NugrahaBelum ada peringkat
- Termokimia B1Dokumen23 halamanTermokimia B1AMALAY RAFFLI ARNOLDYBelum ada peringkat
- Pemisahan Metode SulfatDokumen3 halamanPemisahan Metode SulfatsausanBelum ada peringkat
- Dka 1 Laporan PraktikumDokumen12 halamanDka 1 Laporan PraktikumNurul Fitriani parhanBelum ada peringkat
- Percobaan 3 Penentuan Kadar TembagaDokumen15 halamanPercobaan 3 Penentuan Kadar TembagaNursan Septhyani SaenNichanBelum ada peringkat
- Kelompok 4a - Rizki Ardiyanto - 2282200017 - Laporan Praktikum Kimia Anorganik Iii - HalogenDokumen23 halamanKelompok 4a - Rizki Ardiyanto - 2282200017 - Laporan Praktikum Kimia Anorganik Iii - HalogenRIZKI ARDIYANTOBelum ada peringkat
- Laporan Medan LiganDokumen27 halamanLaporan Medan LiganFikriyanti Wardani100% (1)
- Tugas Pendahuluan Percobaan IVDokumen2 halamanTugas Pendahuluan Percobaan IVBuyung FarhanBelum ada peringkat
- Acara 1 Garam Rangkap Dan KompleksDokumen13 halamanAcara 1 Garam Rangkap Dan KompleksYovanni AurelliaBelum ada peringkat
- Penamaan Senyawa KoordinasiDokumen1 halamanPenamaan Senyawa KoordinasiFebbi MiyentiBelum ada peringkat
- TawasDokumen8 halamanTawasSita Aurelia AuritaBelum ada peringkat
- Kelompok 4 Senyawa KarbonDokumen33 halamanKelompok 4 Senyawa KarbonEryca Nur Bela NegaraniBelum ada peringkat
- Ininda Tamu Ina Wulang - Laprak3 - DDKano-dikonversiDokumen13 halamanIninda Tamu Ina Wulang - Laprak3 - DDKano-dikonversiMuti AngelinaBelum ada peringkat
- Laprak Garam MohrDokumen12 halamanLaprak Garam MohrJokoSuswono0% (1)
- Koordinasi RifkaDokumen3 halamanKoordinasi RifkaRifkaAprillianaBelum ada peringkat
- LAPORAN PRAKTIKUM KIMIA ANORGANIK 1 ReakDokumen6 halamanLAPORAN PRAKTIKUM KIMIA ANORGANIK 1 ReakMuhammad DamriBelum ada peringkat
- Bab 6 Kesetimbangan FasaDokumen27 halamanBab 6 Kesetimbangan FasaKhairul RijalBelum ada peringkat
- Analisis Kualitatif Zat OrganikDokumen47 halamanAnalisis Kualitatif Zat OrganikDiah PurnamiBelum ada peringkat
- Pembuatan TawasDokumen9 halamanPembuatan TawasZulitaBelum ada peringkat
- Laporan Resmi - Praktikum Analitik - Analisis Pendahuluan - Kelompok 1Dokumen19 halamanLaporan Resmi - Praktikum Analitik - Analisis Pendahuluan - Kelompok 1PUTRI LARASATIBelum ada peringkat
- Percobaan IDokumen15 halamanPercobaan IrimaindriBelum ada peringkat
- Term Odin A MikaDokumen143 halamanTerm Odin A MikaMelita RachmaBelum ada peringkat
- Identifikasi Kation MerkuriDokumen8 halamanIdentifikasi Kation MerkuriYafie Al IslamiBelum ada peringkat
- Kelarutan Zat Padat Dalam Cairan Sebagai Fungsi SuhuDokumen20 halamanKelarutan Zat Padat Dalam Cairan Sebagai Fungsi SuhuNurRiskawatiBelum ada peringkat
- LAPORAN KIMIA ANORGANIK I Sintesis Garam Kalium NitratDokumen9 halamanLAPORAN KIMIA ANORGANIK I Sintesis Garam Kalium NitratWidya ChaniagoBelum ada peringkat
- Laporan Sintesis Kristal Tunggal BesarDokumen8 halamanLaporan Sintesis Kristal Tunggal BesarNurul annisa fitriBelum ada peringkat
- Kimia HalogenDokumen19 halamanKimia HalogenSari Rosiati Nur KBelum ada peringkat
- Laporan Praktikum Isoterm AdsorpsiDokumen21 halamanLaporan Praktikum Isoterm AdsorpsiBilwa TakasqBelum ada peringkat
- Report Book-Dds - Rian Elfries Panjaitan - 200332618049Dokumen9 halamanReport Book-Dds - Rian Elfries Panjaitan - 200332618049RIAN ELFRIESBelum ada peringkat
- Laporan Praktikum Kimia Anorganik Bilangan Oksidasi NitrogenDokumen13 halamanLaporan Praktikum Kimia Anorganik Bilangan Oksidasi NitrogenFarid AriyantoBelum ada peringkat
- Modul 5 Ketetapan KesetimbanganDokumen18 halamanModul 5 Ketetapan KesetimbanganSri Dwi AryaniBelum ada peringkat
- Percobaan 9Dokumen3 halamanPercobaan 9SHINE SHINEBelum ada peringkat
- Kimia AnorganikDokumen2 halamanKimia AnorganikAstika RahayuBelum ada peringkat
- Kelarutan Suatu Senyawa Dalam Suatu Pelarut Didefinisikan Sebagai Jumlah TerbanyakDokumen2 halamanKelarutan Suatu Senyawa Dalam Suatu Pelarut Didefinisikan Sebagai Jumlah TerbanyakIka Sri HardyantiBelum ada peringkat
- Laporan Kiman FixDokumen16 halamanLaporan Kiman FixYaumil Agus AkhirBelum ada peringkat
- Percobaan 6 Sintesis Tawas KaliumDokumen10 halamanPercobaan 6 Sintesis Tawas KaliumSiti RochmawatiBelum ada peringkat
- DKA - LK Tugas Kel 4Dokumen5 halamanDKA - LK Tugas Kel 4Danang PK-1B0% (1)
- LAPRAK Kinwtika KimiaDokumen18 halamanLAPRAK Kinwtika KimiaDanang PK-1BBelum ada peringkat
- Modul Kesetmbangan Dalam Larutan IodinDokumen3 halamanModul Kesetmbangan Dalam Larutan IodinM Nur M. MahmudBelum ada peringkat
- Pembuatan Nikel DMGDokumen6 halamanPembuatan Nikel DMGNicholas ReedBelum ada peringkat
- Laporan Kalium NitratDokumen15 halamanLaporan Kalium NitratAbdul ThalibBelum ada peringkat
- Laporan Akhir Praktikum Kimia Analitik I Percobaan 1 Uji PendahuluanDokumen12 halamanLaporan Akhir Praktikum Kimia Analitik I Percobaan 1 Uji Pendahuluananggi nadiaBelum ada peringkat
- Laporan Praktiikum Air KristalDokumen16 halamanLaporan Praktiikum Air KristalNur Annisa0% (1)
- FenolDokumen24 halamanFenolRizaldi Putra HaryantoBelum ada peringkat
- Acara IV Laporan Kimia OrganikDokumen17 halamanAcara IV Laporan Kimia OrganikNurul Fitriani parhanBelum ada peringkat
- Ciprofloxacin - Iodometri - PulihkanDokumen14 halamanCiprofloxacin - Iodometri - PulihkanLelih nurilahBelum ada peringkat
- Laporan Praktikum Kimia Dasar 3Dokumen8 halamanLaporan Praktikum Kimia Dasar 3harfiana safitri08Belum ada peringkat
- Mol ViewDokumen7 halamanMol ViewKhoer UmmahBelum ada peringkat
- TEORI BELAJAR BEHAVIORISTIK - CekDokumen19 halamanTEORI BELAJAR BEHAVIORISTIK - CekKhoer UmmahBelum ada peringkat
- Khoerul Ummah - RPP Hidrokarbon UwuDokumen32 halamanKhoerul Ummah - RPP Hidrokarbon UwuKhoer UmmahBelum ada peringkat
- Asfiyatus Sundusiyah 1808076046 Chemdraw 1Dokumen1 halamanAsfiyatus Sundusiyah 1808076046 Chemdraw 1Khoer UmmahBelum ada peringkat
- KHOERUL UMMAH CantikDokumen2 halamanKHOERUL UMMAH CantikKhoer UmmahBelum ada peringkat
- Laporan Observasi Ma Nahdlatul MusliminDokumen7 halamanLaporan Observasi Ma Nahdlatul MusliminKhoer UmmahBelum ada peringkat
- Kelompok 4 - Metopen (R & D)Dokumen16 halamanKelompok 4 - Metopen (R & D)Khoer UmmahBelum ada peringkat
- KHOERUL UMMAH - 1808076062 - UTS KomputasiDokumen7 halamanKHOERUL UMMAH - 1808076062 - UTS KomputasiKhoer UmmahBelum ada peringkat
- Makalah Kelompok 2Dokumen15 halamanMakalah Kelompok 2Khoer UmmahBelum ada peringkat
- Khoerul Ummah - 1808076062 - Proposal SkripsiDokumen49 halamanKhoerul Ummah - 1808076062 - Proposal SkripsiKhoer UmmahBelum ada peringkat
- Khoerul Ummah - 1808076062 - RPP 1 Lembar Hidrokarbon.Dokumen4 halamanKhoerul Ummah - 1808076062 - RPP 1 Lembar Hidrokarbon.Khoer UmmahBelum ada peringkat
- Ummah RekristalisasiDokumen37 halamanUmmah RekristalisasiKhoer UmmahBelum ada peringkat
- Makalah Kelompok 1Dokumen9 halamanMakalah Kelompok 1Khoer UmmahBelum ada peringkat
- ID NoneDokumen9 halamanID Noneyosua girsangBelum ada peringkat
- Sejarah Peradaban Islam Pada Masa Nabi Muhammad SAWDokumen27 halamanSejarah Peradaban Islam Pada Masa Nabi Muhammad SAWKhoer UmmahBelum ada peringkat
- Elusidasi Struktur-Contoh-2Dokumen9 halamanElusidasi Struktur-Contoh-2Khoer UmmahBelum ada peringkat
- Produksi, Preservasi Materi OrganikDokumen21 halamanProduksi, Preservasi Materi OrganikKhoer UmmahBelum ada peringkat
- Uas Fiqih - Khoerul Ummah 1808076062Dokumen21 halamanUas Fiqih - Khoerul Ummah 1808076062Khoer UmmahBelum ada peringkat
- Metode Pendidikan IslamDokumen19 halamanMetode Pendidikan IslamKhoer UmmahBelum ada peringkat
- Makalah Fki Kel. 1Dokumen13 halamanMakalah Fki Kel. 1Khoer UmmahBelum ada peringkat
- Metalurgi PDFDokumen20 halamanMetalurgi PDFKhoer UmmahBelum ada peringkat
- Summary Metalurgi - KHOERUL UMMAH - 1808076062Dokumen2 halamanSummary Metalurgi - KHOERUL UMMAH - 1808076062Khoer UmmahBelum ada peringkat
- Laporan Praktikum Kimia Logam Dan Non Logam Pembuatan Senyawa KoordinasiDokumen8 halamanLaporan Praktikum Kimia Logam Dan Non Logam Pembuatan Senyawa KoordinasiKhoer UmmahBelum ada peringkat
- Kurikulum Pendidikan Islam FiksDokumen17 halamanKurikulum Pendidikan Islam FiksKhoer UmmahBelum ada peringkat
- RPS - Falsafah Kesatuan Ilmu - Lis Setiyo NingrumDokumen13 halamanRPS - Falsafah Kesatuan Ilmu - Lis Setiyo NingrumKhoer UmmahBelum ada peringkat
- Teori Atom Dan Aplikasinya PK4CDokumen42 halamanTeori Atom Dan Aplikasinya PK4CKhoer UmmahBelum ada peringkat
- Makalah Fki Kel. 1Dokumen13 halamanMakalah Fki Kel. 1Khoer UmmahBelum ada peringkat
- XRD Ummah CantikDokumen13 halamanXRD Ummah CantikKhoer UmmahBelum ada peringkat
- FKI Kel 10 - STRATEGI MENJALANKAN KESATUAN ILMU PENGETAHUAN DALAM SPIRITUALISASI SCIENCEDokumen13 halamanFKI Kel 10 - STRATEGI MENJALANKAN KESATUAN ILMU PENGETAHUAN DALAM SPIRITUALISASI SCIENCEKhoer UmmahBelum ada peringkat
- KimlogDokumen6 halamanKimlogKhoer UmmahBelum ada peringkat